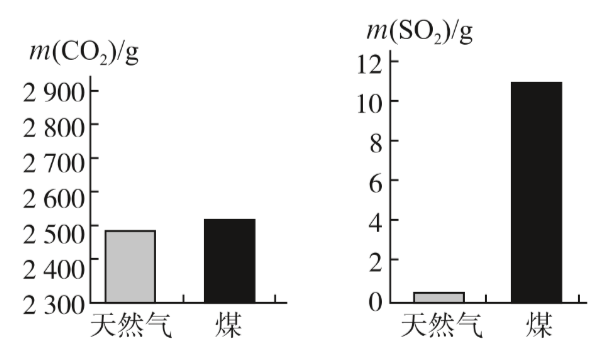
(多选)t$_1$℃时,分别将20g甲、乙两种晶体(不含结晶水)加入盛有100g水的两个烧杯中,恰好完全溶解,升温到t$_2$℃时出现甲、乙烧杯中所示的现象.根据上述实验,结合图中甲、乙两物质的溶解度曲线,判断下列说法正确的是( )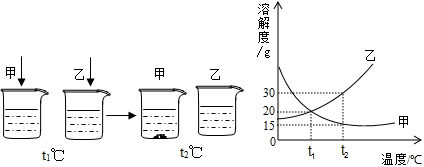
题目答案
您的答案
答案解析
分析:
根据固体物质的溶解度曲线可以:①查出某物质在一定温度时的溶解度,从而可以确定出形成的溶液是否饱和,②比较不同物质在同一温度时的溶解度大小,从而可以比较出其饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而可以判断温度变化时溶液中量的变化等.
解答:
解:A、由于在t$_1$℃时,两种物质的溶解度都是20g,即100g水中最多溶解20g,因此将20g甲和乙分别加入到100g,甲和乙会全部溶解形成饱和溶液,故A错误;
B、由于甲和乙都全部溶解,因此形成的溶液中溶质的质量分数为$\frac {20g}{100g+20g}$×100%=16.7%,故B正确;
C、由于甲的溶解度随温度的升高而减小,因此升温至t$_2$℃时,甲的溶解度是15g,甲的饱和溶液中就会析出5g晶体,溶液的质量也就由120g变成115g,故C错误;
D、根据乙的溶解度曲线不难看出,在t$_2$℃时,乙的溶解度是30g,故D正确;
故选BD.
点评:
本题难度不是很大,主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决相关的问题.