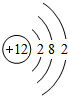
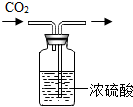
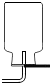
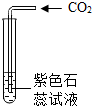
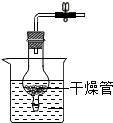
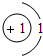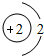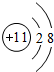(多选)下列粒子结构示意图中,表示相对稳定结构的是( )
题目答案
您的答案
答案解析
分析:
通常认为最外层有8个电子(只有一个电子层的具有2个电子)的结构是一种稳定结构,根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行分析解答.
解答:
解:A、该粒子核内质子数=核外电子数,为原子,只有一个电子层的具有2个电子是一种稳定结构,该粒子的最外层电子数为1,故该粒子不具有相对稳定结构.
B、由结构示意图可知,质子数=核外电子数,为原子,最外层是一个电子层且有2个电子,故该粒子具有相对稳定结构.
C、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,最外层为8个电子,故该粒子具有相对稳定结构.
D、该粒子的最外层电子数为2,易失去2个电子,形成8个电子的稳定结构,故该粒子不具有相对稳定结构.
故选BC.
点评:
本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子结构示意图中最外层电子数与得失电子的关系是解题的关键.