根据下列实验装置回答问题:
题目答案
您的答案
答案解析
问题要点
根据实验室制取CO2的反应条件和所用药品的状态可确定实验室制取CO2的发生装置;根据CO2的密度和溶解性可确定CO2的收集装置;评价各自设计的装置的优缺点可从装置是否简便、是否便于加入液体、是否便于控制滴入液体的速率等方面考虑;验满可利用燃着的木条;检验CO2可利用澄清石灰水。
根据下列实验装置回答问题:

根据实验室制取CO2的反应条件和所用药品的状态可确定实验室制取CO2的发生装置;根据CO2的密度和溶解性可确定CO2的收集装置;评价各自设计的装置的优缺点可从装置是否简便、是否便于加入液体、是否便于控制滴入液体的速率等方面考虑;验满可利用燃着的木条;检验CO2可利用澄清石灰水。
铅笔芯为什么有软和硬的差别?这是由于制铅笔芯时常在石墨粉末中掺一些黏土以增加硬度,黏土掺的越多,铅笔芯就越硬。下表为部分普通铅笔的标号及笔芯的原料配比。
原料配比\标号 | 2H | H | HB | 2B |
石墨(质量分数) | 74.0% | 75.2% | 81.3% | 85.5% |
黏土(质量分数) | 26.0% | 24.8% | 18.7% | 14.5% |
请回答下列问题:
根据题中信息“黏土掺的越多,铅笔芯就越硬”可知,硬度最大的是2H铅笔;若要验证石墨的导电性,应选择石墨含量最高的2B铅笔;由于石墨太软,故不适合直接做笔芯。
如图是某同学设计的实验室制取氧气的实验装置图,请回答下列问题:

木炭还原氧化铜的实验装置如图所示,据图回答问题。

木炭还原氧化铜的反应条件是高温,一般用酒精喷灯加热,如用酒精灯则需要加金属网罩以提高温度。
某同学设计了如下实验,取四朵用石蕊溶液染成紫色的干燥纸花,分别按图Ⅰ~Ⅳ进行实验,请回答:




下列四个实验是探究稀硫酸与$NaOH$、$NaCl$、$Na _ {2} CO _ {3} 、 Ba ( NO _ {3} ) _ {2}$溶液能否发生复分解反应:
A.$H _ {2} SO _ {4} + NaOH$ B.$H _ {2} SO _ {4} + NaCl$
C.$H _ {2} SO _ {4} + Na _ {2} CO _ {3}$ D.$H _ {2} SO _ {4} + Ba ( NO _ {3} ) _ {2}$
将 $6.8$ $\rm g$ 含杂质的锌粒加入到 $80$ $\rm g$ 过量的稀硫酸中(杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为 $86.3$ $\rm g$。试计算:
合理利用能源和保护环境是我们关注的问题。
李梅同学在学习“金属材料”一课后,在家里收集了一些金属材料,其中有①铁片、钢片;②黄铜片、纯铜片;③纯铝片、铝合金片等。
常用刻画法比较硬度,用合金在其成分金属上刻画,成分金属上留有痕迹,说明合金的硬度大于成分金属的硬度;常用加热法比较熔点高低,同时加热合金及成分金属,合金先熔化,证明合金比成分金属熔点低。
节约能源、保护环境、低碳生活是全社会应该倡导的生活方式。
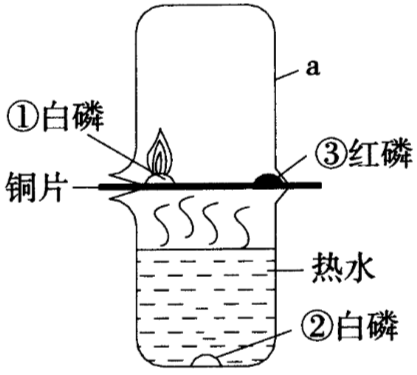
某教师在教学(燃烧的条件)中改进了教材中的实验。如图所示,在铜片上罩了仪器a,请回答:
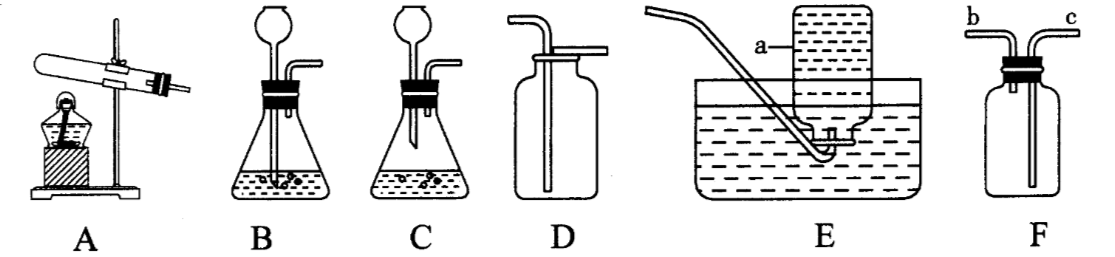
图是实验室制取气体的常用装置。
通过加热高锰酸钾制取氧气的实验,学习如何确定实验所需要的仪器、装置的连接、操作步骤及注意事项,并用“从个别到一般”的思想去学习制取气体的发生装置和收集装置。固体之间反应且反应需要加热,可用图中B装置;固体和液体反应且反应不需加热,可用图中A装置。密度比空气大,且不与空气中成分反应的气体可用图中D装置收集;密度比空气小,且不与空气中成分反应的气体可用图中C装置收集;不溶于水且不与水反应的气体可用图中E装置收集。
采用加热高锰酸钾分解制取氧气的方法,并以该实验为依托,学习制取氧气的实验操作。考查实验室制取氧气的装置、验满等知识。选择气体制取装置的一般思路:根据反应物的状态和反应条件可以确定发生装置;根据气体的性质可以确定收集装置。
沼气是洁净的气体燃料之一,是解决农村能源不足的一条重要途径。
空气是由什么组成的
全球能源生产正向“氢能经济”转型,以可再生生物资源(如纤维素等)为原料生产氢气已成为能源研究的重点。下图是某新型能源转换与利用模式示意图。

如图所示地壳中所含各种元素的质量分数。请根据该图回答下列问题:

图中的金属元素有铝、铁、钙、钠、钾、镁6种。地壳中含量最多的非金属元素是氧元素,形成的单质是氧气;含量最多的金属元素是铝元素;含量占第二位的金属元索是铁元素。铁在氧气中燃烧的现象为剧烈燃烧,火星四射,放热,生成黑色固体。
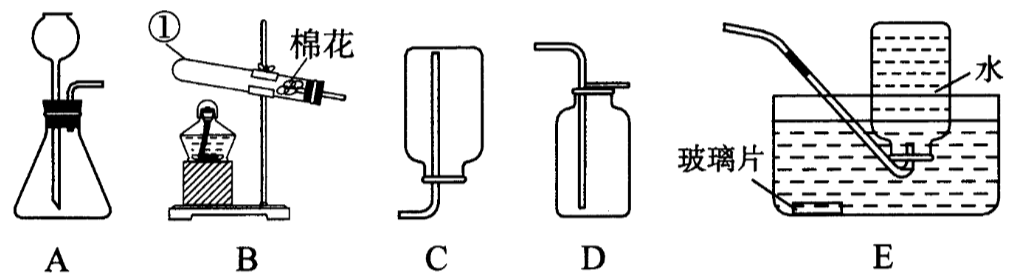
如图所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
根据二氧化碳的制取原理、物理性质和化学性质解答这类题型。二氧化碳的制取装置是固液不加热型;二氧化碳可溶于水,密度比空气大,所以不能用排水法收集,只能用向上排空气法收集;又因为二氧化碳不支持燃烧,所以验满的方法和现象是将燃着的木条放在集气瓶口,燃烧的木条熄灭。F是万能瓶,收集气体时,永远是短管进气、长管出水;检验或除杂时,气体永远是长管进、短管出,以保证气体与液体充分接触。中考命题中通常将氧气与二氧化碳的制取放在一起考查,根据两者反应物的状态和反应条件选择反应装置,根据两者可溶性和密度大小选择收集装置,根据两者的化学性质判断检验和验满的方法及现象。
某同学欲测定某石灰石样品中碳酸钙的质量分数。取12.5g石灰石样品于烧杯中,再向其中加入100g稀盐酸,恰好完全反应,测得烧杯内剩余物质的总质量为108.1g(假设石灰石中的杂质既不溶于水,也不与其他物质反应,生成的二氧化碳全部逸出)。试计算:
某同学用如图所示的两个装置验证质量守恒定律。

(提示:碳酸钠+盐酸→氯化钠+水+二氧化碳)
探究质量守恒定律的实验,如果有气体参加或者生成,反应必须在密闭容器中进行。
某学生写了下面6个化学方程式。
A.$Mg + O _ {2} = MgO _ {2}$
B. $2 P _ {2} + 5 O _ {2} \stackrel {\text {点燃}} {=} 2 P _ {2} O _ {5}$
C. $Cu _ {2} ( OH ) _ {2} CO _ {3} = CuO \downarrow + H _ {2} O + CO _ {2} \uparrow$
D. $3 Fe + 2 O _ {2} \uparrow = Fe _ {3} O _ {4}$
E. $Zn + H _ {2} SO _ {4} = ZnSO _ {4} + H _ {2}$
F. $Cu O + H _ {2} = Cu \downarrow + H _ {2} O$
其中(填序号):
A中氧化镁(MgO)的化学式错误,且没有标注条件“点燃”;B中磷(P)的化学式错误;C中没有配平,没有标注条件“加热”或“△”,且CuO右边的“↓”使用不当;D中没有标注条件“点燃”,且O2是反应物,不应标注“↑”;E中反应物没有气体,生成的H2右边应标注“↑”;F中没有标注条件“加热”或“△”,且Cu右边的“↓”使用不当。