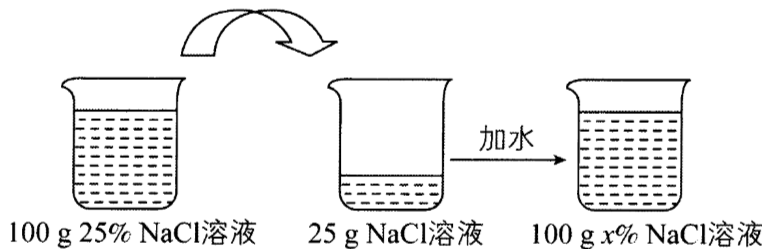
100g25%的NaCl溶液按如图操作处理后,所得溶液的溶质质量分数为x%,x的值是()
题目答案
您的答案
答案解析
根据溶液稀释前后溶质的质量不变,则25g×25%=100g×x%,解得x=6.25。故选选项1-。
100g25%的NaCl溶液按如图操作处理后,所得溶液的溶质质量分数为x%,x的值是()

根据溶液稀释前后溶质的质量不变,则25g×25%=100g×x%,解得x=6.25。故选选项1-。
t℃时,将mgKNO3的不饱和溶液恒温蒸发水分,直到有少量晶体析出,在此过程中,溶液的溶质质量分数(a%)与时间(t)的变化关系可表示为下图中的()
将mgKNO3的不饱和溶液恒温蒸发水分,在没蒸发水分前该溶液的溶质质量分数不为零;开始蒸发水分时,溶质质量不变,溶剂质量减小,所以溶质质量分数增大;当溶液达到饱和后再蒸发水分就会析出晶体,这时溶质质量分数只与该温度下的溶解度有关,因为是恒温蒸发,所以温度不变,溶解度不变,故溶质质量分数也不变,故选选项3-。
2019年禽流感疫情仍在持续,相关药物主要是抗生素、板蓝根等。一种抗生素为粉末状固体,每瓶含0.5g,注射时应将其配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()
根据题意可知,配制的溶液的质量=溶质的质量溶质的质量分数 =0.5g20%=2.5g,而所需溶剂的质量=溶液的质量-溶质的质量=2.5g-0.5g=2g,合2mL,故选选项2-。
甲醛的化学式是$CH _ {2} O$,某甲醛水溶液里甲醛分子中所含的氢原子与水分子中所含的氢原子数目相等,则该溶液中溶质的质量分数为()
甲醛的化学式是$CH _ {2} O$,1个甲醛分子中含有2个氢原子,1个水分子中含有2个氢原子,某甲醛水溶液里甲醛分子中所含的氢原子与水分子中所含的氢原子数目相等,则甲醛分子和水分子的个数比为1∶1;甲醛的相对分子质量为$12 + 1 \times 2 +$$16 = 30$,水的相对分子质量为$1 \times 2 + 16 = 18$;所以该溶液中溶质的质量分数为$\frac {30} {30 + 18} \times 100 \% = 62.5 \%$。
对1008溶质质量分数为10%的某物质的溶液,分别进行如下操作:
①加人10g水;
②加入10g同种溶质,且完全溶解;
③加入溶质质量分数为10%的同种溶质的溶液10g;
④蒸发掉10g水,无晶体析出。
操作后的四种溶液中溶质质量分数由小到大的顺序是( )
在公式上进行加减溶质、溶剂的质量时应注意:加溶质时,分子、分母都要加,加减溶剂时,只在分母上加减。
此类题目出错的原因主要是不明确溶质或溶剂改变时,在公式上如何对数据进行处理。100g溶质质量分数为10%的某物质的溶液中溶质的质量是100g×10%=10g。
①加入10g水,溶质质量分数小于10%;
②加入10g同种溶质,且完全溶解,溶质质量分数为10g+10g10g+100g×100%≈18.2%;
③加入溶质质量分数为10%的同种溶质的溶液10g,溶质质量分数不变,仍为10%;
④蒸发掉10g水且无晶体析出,溶质质量分数为10g100g−10g×100%≈11.1%。
故选选项2-。
常温下,在15g氯化钠中加入60g水,完全溶解后,溶液中氯化钠的质量分数为()
15g氯化钠完全溶于60g水中形成的溶液中,氯化钠的质量分数为15g15g+60g×100%=20%。
有一瓶溶质质量分数为20%的氯化钾溶液,关于该溶液的说法正确的是()
溶质质量分数为20%的氯化钾溶液,其含义是每100份质量的氯化钾溶液中含有20份质量的氯化钾,即溶液中溶质和溶液的质量之比是20∶100=1∶5,溶质和溶剂的质量之比为20∶80=1∶4,溶剂和溶液的质量之比为860∶100=4∶5,故选项B正确。
某温度时,A物质的溶解度是25g,则A的饱和溶液中溶质的质量分数是()
饱和溶液中溶质的质量分数= 溶解度 溶解度 +100g×100%。某温度时,A物质的溶解度是25g,则A的饱和溶液中溶质的质量分数是25g25g+100g×100%=20%。
将10g溶质质量分数为10%的氯化钠溶液变为20%,下列操作正确的是( )
设加入氯化钠的质量为x,根据题意有10g×10%+x10g+x×100%=20%,解得x=1.25g,选项A错误;
设蒸发水的质量为y,10 g×10%10g−y×100%=20%,解得y=5g,选项B正确;
由于溶液具有均一性,倒出一半溶液,剩余溶液的质量分数仍为10%,选项C错误;
将10g溶质质量分数为20%的氯化钠溶液加入10g溶质质量分数为10%的氯化钠溶液中,混合后溶液的浓度小于20%,选项D错误。
泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是( )
①称量好的食盐倒入烧杯时,有少许洒出
②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液.
分析:
溶质氯化钠质量偏小或溶剂水的体积偏大,是导致配制氯化钠溶液时溶质质量分数偏小即溶液中NaCl质量分数小于4%的原因.
解答:
①称量好的食盐倒入烧杯时,有少许洒出导致溶解氯化钠质量偏小,所配制氯化钠溶液的质量分数偏小;②用量筒量取水时俯视读数,读数大于所量水的实际体积,使量取水的体积偏小,所配制氯化钠溶液的质量分数偏大;③溶解食盐的烧杯内壁是潮湿的,水的体积因此而偏大,所配制氯化钠溶液的质量分数偏小;④用4g食盐和100g水配制溶液溶质的质量分数是:4g100g+4g×100%=3.8%,所配制氯化钠溶液的质量分数偏小.答案:B.
点评:
抓住导致配制溶液时所出现误差的根本原因:溶质量或多或少、溶剂量或多或少,分析操作对溶质、溶剂量所造成的影响,使此类问题可以轻松解决.
实验室用氯化钠固体配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是()
配制100g溶质质量分数为8%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,选项A说法正确。
配制100g溶质质量分数为8%的氯化钠溶液,需氯化钠的质量为100gx8%=8g,需水的质量为100g-8g=92g(合92mL),应用规格为100mL的量筒量取水,选项B说法正确。
用量筒量取水时,俯视液面,会造成实际量取的水的体积偏小,使溶质质量分数偏大,选项C说法错误。
溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率,选项D说法正确。