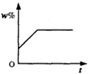
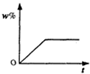
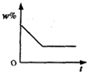
将100g食盐的不饱和溶液恒温蒸发水,直到有少量的晶体析出,在此过程中,关于溶质的质量分数(w%)与时间(t)的变化关系,下列图中描述正确的是( )
题目答案
您的答案
答案解析
分析:
恒温蒸发直至有晶体析出,在此变化过程中,溶液中溶质质量分数w%并不是从零开始的,随着时间的增加,其溶质质量分数会越来越大.直到有晶体析出,溶液达到饱和时,溶质质量分数达到最大且不再发生改变.
解答:
A、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,而不是继续增大,故A错误;
B、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,故B正确;
C、溶液中溶质质量分数w%并不是从零开始的,故C错误;
D、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故D错误.
故选B.
点评:
本题将变化过程放入坐标系中进行探究,使得变化过程图象化,体现了变化的数形结合,能很好训练学生对相关知识的分析能力.