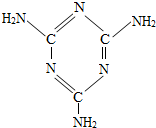
有些年轻人喜欢染发,染发时一般要用一种着色剂--对苯二胺,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示,下列有关对苯二胺的说法不正确的是( )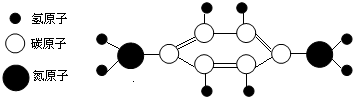
题目答案
您的答案
答案解析
分析:
从图形中分析出化学式,并从化学式中分析得出化学式所表示的含义.由图中可知,该物质的一个分子中有6个碳原子、8个氢原子和2个氮氮原子.
解答:
解:A、从图中可知,一个对苯二胺分子中有6个碳原子、8个氢原子和2个氮原子,所以是C$_6$H$_8$N$_2$,故选项说法正确;
B、对苯二胺的化学式为C$_6$H$_8$N$_2$;所以其相对分子质量=12×6+8+14×2=108,故选项说法正确;
C、对苯二胺的化学式为C$_6$H$_8$N$_2$;所以其相对分子质量=12×6:8:14×2=72:8:28=18:2:7,故选项说法不正确;
D、一个碳原子有六个质子,一个氢原子一个质子,一个氮原子7个质子,所以6个碳8个氢2个氮原子共58个质子,故选项说法正确.
故选C
点评:
本题以生活中使用的染发剂的一种成分为例,考查了根据图示微观粒子结构判断关于相关的化学用语的正误和物质的分类,对基础知识点的应用能力;将化学与生活联系在一起,使学生深刻认识到化学源于生活.