6g碳可以与多少克的氧气恰好完全反应生成二氧化碳( )
题目答案
您的答案
答案解析
分析:
根据碳在氧气燃烧的化学方程式,由参加反应的碳的质量,计算出消耗氧气的质量即可.
解答:
解:设充分燃烧需消耗氧气质量为x,
C+O$_2$$\xlongequal[]{点燃}$CO$_2$
12 32
6g x
$\frac {12}{32}$=$\frac {6g}{x}$
x=16g
故选:C.
点评:
本题难度不大,掌握利用化学方程式的计算方法即可正确解答本题.
6g碳可以与多少克的氧气恰好完全反应生成二氧化碳( )
分析:
根据碳在氧气燃烧的化学方程式,由参加反应的碳的质量,计算出消耗氧气的质量即可.
解答:
解:设充分燃烧需消耗氧气质量为x,
C+O$_2$$\xlongequal[]{点燃}$CO$_2$
12 32
6g x
$\frac {12}{32}$=$\frac {6g}{x}$
x=16g
故选:C.
点评:
本题难度不大,掌握利用化学方程式的计算方法即可正确解答本题.
12g碳与38g O$_2$反应后(生成物只有二氧化碳),根据反应物之间的质量比判断反应情况是( )
分析:
根据题意可以写成其化学方程式:C+O$_2$$\xlongequal[]{点燃}$ CO$_2$,根据化学方程式中质量关系的含义可知,每有12份质量碳和32份质量的氧气恰好完全反应;所以可知碳和氧气完全反应的质量比为3:8.因为题干中已知的是“12g碳与38g O$_2$反应后”,那么可知氧气有剩余.
解答:
解:根据化学方程式C+O$_2$$\xlongequal[]{点燃}$ CO$_2$,可知其完全燃烧时,碳氧质量之比=3:8;所以当有12g碳与38g O$_2$反应时,12g碳全部反应时,需要32g O$_2$参与反应;而题目中所给是38克,故氧气有剩余.
故选:B.
点评:
本题考查了化学方程式中反应物的质量关系,这是初中化学的一个重点也是难点;在解答给类型题目时,只要能够正确写出化学方程式中的数量关系,即可判断反应物之间的数量关系.
在隔绝空气下,用木炭还原氧化铜.下列叙述正确的是( )
分析:
根据木炭还原氧化铜的反应原理书写方程式,根据方程式进行分析,并作出正确的判断.
解答:
解:木炭还原氧化铜的化学反应方程式为:C+2CuO$\xlongequal[]{高温}$2Cu+CO$_2$↑.
A、根据该反应方程式知,反应前固体CuO中含有氧原子,反应后固体Cu中不含有氧原子,所以该叙述错误;
B、根据质量守恒定律知,反应前后固体减轻的质量等于反应后生成的二氧化碳的质量,所以该叙述错误;
C、根据该反应方程式知,反应中消耗的氧化铜的物质的量是碳的物质的量的2倍,所以该叙述错误;
D、根据该反应方程式知,反应中铜元素在固体中的质量分数逐渐变n,所以该叙述正确;
故选D.
点评:
解答此题时,需要正确书写化学方程式.书写化学方程式要遵守两个原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等.
下列性质属于化学性质的是( )
分析:
物质的沸点、硬度、溶解性等方面的性质不需要通过化学变化表现出来,属于物质的物理性质;物质的还原性需要通过化学变化表现出来,属于物质的化学性质.
解答:
A、物质的沸点不需要通过化学变化表现出来,属于物质的物理性质;
B、物质的硬度不需要通过化学变化表现出来,属于物质的物理性质;
C、物质的还原性需要通过化学变化表现出来,属于物质的化学性质;
D、物质的溶解性不需要通过化学变化表现出来,属于物质的物理性质.
故选C.
点评:
解答本题要分析物质的性质是否需要通过化学变化表现出来,如果需要通过化学变化表现出来就属于物质的化学性质.
下列物质中,不具有还原性的是( )
分析:
根据物质的性质分析回答,O$_2$具有氧化性,CO、C、H$_2$具有还原性.
解答:
解:A、O$_2$具有氧化性,不具有还原性,符合题意;
B、一氧化碳具有可燃性,又具有还原性,不符合题意;
C、碳既有可燃性,又有还原性,不合题意;
D、氢气既有可燃性,又有还原性,不符合题意;
故选A.
点评:
本题主要考查了几种常见的还原性物质的知识,一氧化碳、氢气、碳是初中化学中最常用的三种具有还原性的物质,有时还会结合实验装置对这三种物质的还原性进行考查,所以掌握这三种物质的性质是解答的关键,平时要注意对知识的归纳和整理.
将装有木炭粉和氧化铜的试管加热一段时间(如图),发现试管内固体质量减少了,减少的这部分质量是参加反应的( )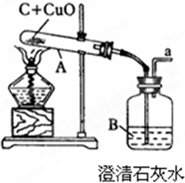
分析:
根据在加热的条件下,木炭粉和氧化铜的反应及质量守恒定律进行分析.
解答:
解:在加热的条件下,木炭粉和氧化铜的反应生成了二氧化碳和铜.由此可知;
A、在加热的条件下,碳夺取氧化铜中的氧生成了二氧化碳气体,所以,减少的质量不只是碳元素的质量,故A错误;
B、铜元素的质量没有变化.故B错误;
C、铜元素的质量没有变化.故C错误;
D、在加热的条件下,碳夺取氧化铜中的氧生成了二氧化碳气体,所以,减少的质量是氧元素和碳元素的质量.故D正确.
故选D.
点评:
解题的关键时根据反应的方程式及质量守恒定律分析质量变化的原因是在加热的条件下,碳夺取氧化铜中的氧生成了二氧化碳气体.
有关2Fe$_2$O$_3$+3C$\xlongequal[]{高温}$4Fe+3CO$_2$↑这个反应中,说法正确的是( )
分析:
由化学方程式分析,反应前后得到氧的物质发生氧化反应,失去氧的物质发生还原反应,氧化剂具有氧化性,还原剂具有还原性.
解答:
解:此反应中,反应前后物质的变化情况是:Fe$_2$O$_3$→Fe,C→CO$_2$,氧化铁失去氧,是氧化剂,具有氧化性,碳得到氧,是还原剂,具有还原性,发生氧化反应;反应物为两种固体,生成物中有气体,所以反应后固体质量减少.
故选C.
点评:
本题考查氧化还原反应,对于初中学生来讲偏难,需要明白的是,失去氧的是氧化剂,氧化剂具有氧化性,发生还原反应,得到氧的是还原性,还原剂具有还原性,发生氧化反应.
下列物质中,既有可燃性,又有还原性的固体单质是( )
分析:
根据氢气、木炭既具有可燃性,又具有还原性;二氧化碳与二氧化硫的化学性质进行分析判断.
解答:
解:A、氢气既具有可燃性,又具有还原性,但属于气态单质,故选项错误.
B、二氧化碳不能燃烧,不具有可燃性、还原性,故选项错误.
C、木炭既具有可燃性,又具有还原性,且属于固态单质,故选项正确.
D、二氧化硫不具有可燃性,且属于气体化合物,故选项错误.
故选C.
点评:
本题难度不大,掌握氢气、木炭、二氧化碳与二氧化硫的化学性质即可正确解答本题.
物质不需要通过化学变化就能体现的性质是( )
分析:
物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等.
解答:
解:A、可燃性,需要通过燃烧这一化学反应才能表现出来,属于化学性质,故A错;
B、稳定性,需要通过化学反应才能表现出来,属于化学性质,故B错;
C、溶解性,不需要通过化学变化就能表现出来,属于物理性质,故C正确;
D、还原性,需要通过化学反应才能表现出来,属于化学性质,故D错.
故选C.
点评:
本题难度不大,区分物质的性质属于物理性质还是化学性质,关键是看这条性质是否需要通过化学变化表现出来.
按如图进行实验,有关说法及分析不正确的是( )[br]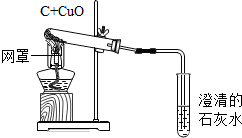
分析:
A.为使反应充分,木炭粉末与CuO粉末须混合均匀;[br]B.酒精灯网罩的作用是提高温度;[br]C.根据二氧化碳性质分析;[br]D.木炭粉末与CuO粉末反应当碳粉过量时会产生一氧化碳;
解答:
解:A.为使反应充分,木炭粉末与CuO粉末须混合均匀;正确;[br]B.酒精灯网罩的作用是提高温度;正确[br]C.木炭粉末与CuO粉末反应产生二氧化碳,二氧化碳能使澄清石灰水变浑浊;正确;[br]D.木炭粉末与CuO粉末反应产生二氧化碳,当碳粉过量时可能会产生一氧化碳;不正确.[br]答案:D.
点评:
本题主要考查碳的化学性质,完成实验探究题时,要明确探究的目的,根据所给信息按步骤进行分析,认真思考反应中的现象,不放过细节问题.
实验室用高锰酸钾制取氧气和用石灰石与稀盐酸制取二氧化碳都不可能用到的装置是( )
分析:
用加热高锰酸钾制氧气生成锰酸钾、二氧化锰和氧气,用稀盐酸和石灰石制取二氧化碳,根据反应物的状态和反应条件选择各自的发生装置,根据氧气和二氧化碳的密度和溶解性选择收集装置,通过对比作出选择.
解答:
实验室常用加热高锰酸钾制氧气,属于固体加热型,故选发生装置A;
实验室常用稀盐酸和石灰石制取二氧化碳,反应物为固体和液体,不需要加热,故应选用的发生装置是 B;
因为氧气和二氧化碳的密度都比空气大,所以都可以向上排空气法、C;
而D装置适合气体的密度比空气小的气体收集,氧气和二氧化碳都不适合;
故选项为:D.
点评:
本题主要考查了氧气和二氧化碳的发生装置、收集方法的选择,关键是明确反应的原理及发生装置和收集装置选择的依据.