分析:
根据题意,要求能做到“随时控制反应进行或停止”,根据制取二氧化碳用大理石(或石灰石)和稀盐酸在常温下反应,属于固液常温型,要想使反应随时发生或随时停止,只要能随时将两种药品接触和分离即可,据此进行分析判断.
解答:
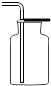
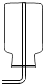
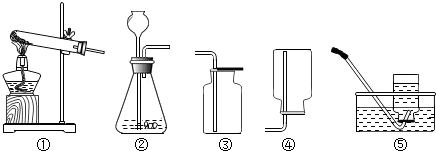
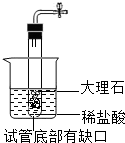
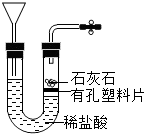
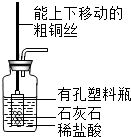
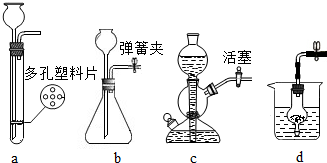
解:a.大理石在多孔塑料片上,要产生气体时,打开弹簧夹,长颈漏斗内的稀盐酸进入试管内与大理石接触产生气体;关闭止水夹,内外产生压强差,大部分盐酸又被压到长颈漏斗内,二者分离,反应停止;该装置能够使反应随时发生或停止.b.虽然弹簧夹可以控制气体的导出,可以使锥形瓶内的气压增大,将稀盐酸部分压入长颈漏斗,但是稀盐酸与大理石接触,无法控制反应的停止.c.大理石在容器内,要产生气体时,打开活塞,球形漏斗内的稀盐酸进入试管内与大理石接触产生气体;关闭止水夹,内外产生压强差,大部分盐酸又被压到球形漏斗内,二者分离,反应停止;该装置能够使反应随时发生或停止.故a、c能随时控制反应进行或停止.d.中的干燥管只要放入烧杯中,稀盐酸可以随时进入干燥管产生气体,不用时可以随时移出干燥管使反应停止,或通过止水夹的开关利用干燥管内的气压加稀盐酸压出干燥管使反应停止,打开止水夹使稀盐酸进入干燥管使反应发生.故该装置能够使反应随时发生或停止故选:B.
点评:
本考点对制取二氧化碳的装置进行了合理的设计和分析,关键是明确反应的原理,考查了学生的视图能力,培养了学生分析问题和解决问题的能力,同时开拓了学生的异向思维.