三棱柱的三视图如图所示,△EFG中,EF=8cm,EG=12cm,∠EGF=30°,则AB的长为cm.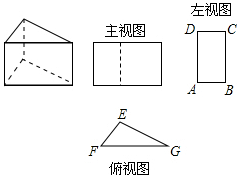
题目答案
您的答案
答案解析
分析:
根据三视图的对应情况可得出,△EFG中FG上的高即为AB的长,进而求出即可.
解答:
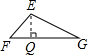 解:过点E作EQ⊥FG于点Q,
解:过点E作EQ⊥FG于点Q,
由题意可得出:EQ=AB,
∵EG=12cm,∠EGF=30°,
∴EQ=AB=$\frac {1}{2}$×12=6(cm).
故答案为:6.
点评:
此题主要考查了由三视图解决实际问题,根据已知得出EQ=AB是解题关键.
三棱柱的三视图如图所示,△EFG中,EF=8cm,EG=12cm,∠EGF=30°,则AB的长为cm.
分析:
根据三视图的对应情况可得出,△EFG中FG上的高即为AB的长,进而求出即可.
解答:
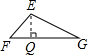 解:过点E作EQ⊥FG于点Q,
解:过点E作EQ⊥FG于点Q,
由题意可得出:EQ=AB,
∵EG=12cm,∠EGF=30°,
∴EQ=AB=$\frac {1}{2}$×12=6(cm).
故答案为:6.
点评:
此题主要考查了由三视图解决实际问题,根据已知得出EQ=AB是解题关键.
在桌上摆着一个由若干个相同正方体组成的几何体,其主视图和左视图如图所示,设组成这个几何体的小正方体的个数为n,则n的最小值为.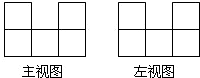
分析:
易得此几何体有三行,三列,判断出各行各列最少有几个正方体组成即可.
解答:
底层正方体最少的个数应是3个,第二层正方体最少的个数应该是2个,因此这个几何体最少有5个小正方体组成,
故答案为:5.
点评:
本题考查了由三视图判断几何体的知识,解决本题的关键是利用“主视图疯狂盖,左视图拆违章”找到所需最少正方体的个数.
2011年3月,日本福岛发生了核泄漏事故,核电站泄漏出来的放射性物质中含有铯﹣137,过量摄入会使人造血系统和神经系统受到损伤。已知铯﹣137的质子数为55,中子数为82,则铯原子核外有个电子,核电荷数为,相对原子质量为。
分析:
[br]根据原子中:核电荷数=质子数=电子数、相对原子质量=质子数+中子数,结合题意进行分析解答.
解答:
[br]解:因为核电荷数=质子数=电子数,由题意铯﹣137的质子数为55,故其核外电子数和核电荷数为55;根据相对原子质量=质子数+中子数,由题意该原子的中子数为82,则铯原子的相对原子质量=82+55=137.[br]故填:55;55;137.
点评:
[br]本题难度不是很大,解题的关键是掌握原子中核电荷数=质子数=电子数、相对原子质量=质子数+中子数.
(1)已知反应:3A+2B═2C+D,其中A、B两物质完全反应时的质量比为3:4.若生成C和D共140g,则该反应消耗B的质量为克.
(2)在化学反应3X+4Y═2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为;如果制取Z 102g,则需要Y物质g.
(3)根据化学方程式A+NaOH═B+H$_2$O推断,B、A的相对分子质量相差.
分析:
(1)根据质量守恒定律可知参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,即参加反应的A和B的质量和跟生成C和D的质量和相等.
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.此题中,参加反应的X和Y的质量和应等于生成物Z的质量,由X和Z的相对分子质量可求Y的相对分子质量.
(3)可以根据质量守恒定律,化学反应前后物质的总质量不变,求出B、A的相对分子质量之差,据此分析解答即可.
解答:
解:(1)由质量守恒定律和3A+2B=2C+D,生成C和D共140g,则参加反应的A和B的质量之和也为140g,而A、B两物质完全反应时的质量比为3:4,故反应消耗B的质量是140g×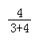 =80g.
=80g.
故填:80.
(2)设则Y的相对分子质量为y,设需要Y的质量为z,则
3X+4Y═2Z
3×32 4y 2×102
z 102g
3×32+4×y=2×102,解得y=27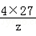 =
=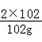 ,解得z=54g
,解得z=54g
故填:27;54.
(3)根据质量守恒定律,A的相对分子质量加上氢氧化钠的相对分子质量等于B的相对分子质量加上水的相对分子质量,A+40═B+18,故B、A的相对分子质量之差为:B﹣A=40﹣18=22.
故填:22.
点评:
解此题的关键是要知道在方程式中找各物质的质量关系时,相对分子质量需要乘以化学计量数.
在4P+5O$_2$═2P$_2$O$_5$中,各物质的分子个数比为::,各物质的质量比是::.
分析:
化学方程式的意义可知:1、表示什么物质参加反应,结果生成了什么物质;2、表示个物质间的原子和分子的个数比;3、表示反应在什么条件下进行;4、表示反应物,生成物各物质间的质量比;通过仔细观察和正确的读法即可找出答案.
解答:
解:
由化学方程式的意义可知:
①反应物磷和氧气的分子个数分别为4和5,生成物氧气的分子个数为2,故各物质的分子个数比为4:5:2;
②反应物磷的质量为4×31=124,氧气的质量为5×32=160,生成物五氧化二磷的质量为124+160=284,各物质的质量比为124:160;284=31:40:71.
故答案为:4:5:2; 31:40:71.
点评:
本题是一道考查化学方程式概念、意义和读法的题目,是初中化学的重点也是难点.化学方程式是化学反应简明的表达形式.它从"质"和"量"两个方面表达了化学反应的意义.(1)"质"的含义 表示什么物质参加了反应,生成了什么物质,以及反应是在什么条件下进行的.(2)"量"的含义 从宏观看,表示了各反应物、生成物间的质量比.如果反应物都是气体,还能表示它们在反应时的体积比.从微观看,如果各反应物、生成物都是由分子构成的,那么化学方程式还表示各反应物、生成物间的分子个数比.
3Fe+2O$_2$$\xlongequal[]{点燃}$Fe$_3$O$_4$反应中,份质量的铁与份质量的氧气反应生成份质量的四氧化三铁,这三种物质之间的质量之比为::.
分析:
化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.但要注意读化学方程式时,"+"应读作"和","═"应读作"生成".根据相对分子质量及化学式前的化学计量数即可得出答案.
解答:
解:物质的质量比等于相对分子质量和的比.
3Fe+2O$_2$$\xlongequal[]{点燃}$Fe$_3$O$_4$
168 64 232
则三者的质量比是168:64:232
故答案为:168;64;232;21:8:29
点评:
本题主要考查学生对元素的相对原子质量和化学方程式意义的认识.
3g碳与10g氧气充分反应后,能生成二氧化碳g.
分析:
由碳和氧气反应生成二氧化碳的质量关系C+O$_2$$\xlongequal[]{点燃}$CO$_2$,可知,3g碳与10g氧气充分反应后氧气过量,应该以碳为基础进行计算.
12 32 44
解答:
解:设生成二氧化碳的质量为x,
C+O$_2$$\xlongequal[]{点燃}$CO$_2$,
12 44
3g x
$\frac {12}{44}$=$\frac {3g}{x}$,
x=11g,
故填:11.
点评:
本题涉及过量问题,因此要根据反应的化学方程式及其反应物、生成物之间的质量关系先确定那种物质过量,那种物质完全反应,然后根据完全反应的物质求未知量.
要配制5升30%的硫酸溶液(密度为1.22克/厘米_),需要98%的浓硫酸(密度为1.84克/厘米_)毫升,加水毫升.
分析:
根据加水稀释时溶质质量不变,计算配制溶质质量分数为30%的稀硫酸5L,需要溶质质量分数为98%(密度为1.84g/cm_)的浓硫酸的体积,同时可以计算出加入水的质量.
解答:
解:5L=5000mL
设需要98%的浓硫酸的体积为x
x•1.84g/mL×98%=5000mL×1.22g/mL×30%
解得:x=1014.9mL
需要加入水的质量为:5000mL×1.22g/mL﹣1015mL×1.22g/mL=4232.7g
故答案为:1014.9; 4232.7
点评:
溶液加水稀释后,溶质质量不变,改变的是溶剂的质量和溶质质量分数.
实验室一瓶浓硫酸的商标如图所示,根据有关信息计算.
(1)启封前该瓶浓硫酸溶液的质量是g.
(2)取该浓硫酸10g,可配制成19.6%的稀硫酸g.
分析:
(1)由标签可读取该瓶浓硫酸的体积500mL、密度1.84g/cm_,利用m=ρV可计算该瓶浓硫酸的质量;
(2)用98%的浓硫酸配制19.6%的稀硫酸需要加水进行稀释,根据稀释前后溶液中硫酸质量不变,由稀释前浓硫酸的质量计算可配制的稀硫酸的质量.
解答:
解:(1)由标签可知该瓶浓硫酸的体积500mL、密度1.84g/cm_,启封前该瓶浓硫酸溶液的质量=500mL×1.84g/cm_=920g
(2)可配制成19.6%的稀硫酸的质量=$\frac {10g×98%}{19.6%}$=50g
故答案为:(1)920;(2)50.
点评:
根据溶液中溶质质量=$\frac {溶质质量}{溶液质量}$×100%,利用其中任意两个已知量可计算出与溶液相关的第三个量.
将100克含水98%的氯化钠溶液的含水量降到96%,应蒸发掉克水.
分析:
根据溶液蒸发前后,溶质的质量不变,结合题意进行分析解答.
解答:
解:设要蒸发水的质量为x,根据溶液蒸发前后,溶质的质量不变,
则100g×(1﹣98%)=(100g﹣x)×(1﹣96%) x=50g.
故答案为:50.
点评:
本题难度不大,考查溶液的蒸发问题,掌握溶液蒸发前后溶质的质量不变是正确解答此类题的关键所在.
工人师傅要用98%的浓硫酸(密度为1.84 g/cm_)稀释成15%的稀硫酸来清洗钢铁的铁锈(水的密度为1 g/cm_),求:
(l)500mL溶质质量分数为98%的浓硫酸的质量为g,其中溶质的质量为g.
(2)将500 mL 98%的浓硫酸稀释成15%的稀硫酸,约需用水mL.
分析:
(1)根据m=ρV,可由浓硫酸的体积和密度计算浓硫酸溶液的质量;利用溶质质量=溶液质量×溶液的质量分数,计算溶液中溶质的质量;
(2)加水稀释时,溶液中溶质质量不变,利用此等量关系,可根据浓硫酸的质量计算出加水稀释时所需要水的量.
解答:
解:(1)500mL溶质质量分数为98%的浓硫酸的质量=500mL×1.84 g/cm_=920g;
其中溶质的质量=920g×98%=901.6g
故答案为:920;901.6;
(2)设需要用水的质量为x
500mL×1.84 g/cm_×98%=(500mL×1.84 g/cm_+x)×15%
x≈5090.7g(合5090.7mL)
故答案为:5090.7
点评:
由于数据较复杂,在进行类似的计算时,数据处理要耐心细致,避免因大意而计算误差造成结果的错误.