2019年禽流感疫情仍在持续,相关药物主要是抗生素、板蓝根等。一种抗生素为粉末状固体,每瓶含0.5g,注射时应将其配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()
题目答案
您的答案
答案解析
根据题意可知,配制的溶液的质量=$\frac {溶质的质量} {溶质的质量分数 \}$=$\frac {0.5 g} {20 \%} = 2.5 g$,而所需溶剂的质量=溶液的质量-溶质的质量=2.5g-0.5g=2g,合2mL,故选选项B。
2019年禽流感疫情仍在持续,相关药物主要是抗生素、板蓝根等。一种抗生素为粉末状固体,每瓶含0.5g,注射时应将其配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()
根据题意可知,配制的溶液的质量=$\frac {溶质的质量} {溶质的质量分数 \}$=$\frac {0.5 g} {20 \%} = 2.5 g$,而所需溶剂的质量=溶液的质量-溶质的质量=2.5g-0.5g=2g,合2mL,故选选项B。
用氯化钠配制 $\rm 100 $ 克溶质质量分数为 $\rm 20\% $ 的氯化钠溶液,现有下列操作:①溶解,②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶,针对该实验说法正确的是( )
$\rm A$.固体溶质加水溶解的配制步骤为计算、称量、量取、溶解,所以本题答案为:⑤②④①;故 $\rm A$ 错误;
$\rm B$.配制 $\rm 100 $ 克溶质质量分数为 $\rm 20\% $ 的氯化钠溶液,所需氯化钠的质量为 $\rm 100~g~\times 20\% =20~g$,所需水的体积为 $\rm 80~mL$,所以需要选择 $\rm 100~mL$ 的量筒,故 $\rm B$ 正确;
$\rm C$.量筒是用来量取液体的体积,但不能用来配制溶液,故 $\rm C$ 错误;
$\rm D$.固体溶解度的概念是指一定温度下 $\rm 100~g$ 溶剂水中达到饱和状态所溶解的溶质的质量,该溶液不一定饱和,故 $\rm D$ 错误;
故选 $\rm B$。
配制 $10\%$ 的氯化钠溶液时,下列会引起溶液中溶质的质量分数偏小的是( )
使溶质质量分数偏小的情况有两种,一种是称取的氯化钠质量偏小,一种是加入的水过多。
A选项:量筒量取时俯视读数,会使实际称取的水的体积小于读数值,因此溶质质量分数偏大,故A错误;
B选项:配置溶液的烧杯用蒸馏水润洗,会使加入的水的质量增大,故溶质质量分数偏小,故B正确;
C选项:天平称量氯化钠时,指针左偏,说明称取氯化钠的质量大于理论值,故溶质质量分数偏大,故C错误;
D选项:溶液已经配好时,溶质质量分数已经确定。不会因为移液而使溶质质量分数发生变化,故D错误;
故选B。
小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为 $1~\text{g}$/$\text{cm}^3$)约为( )
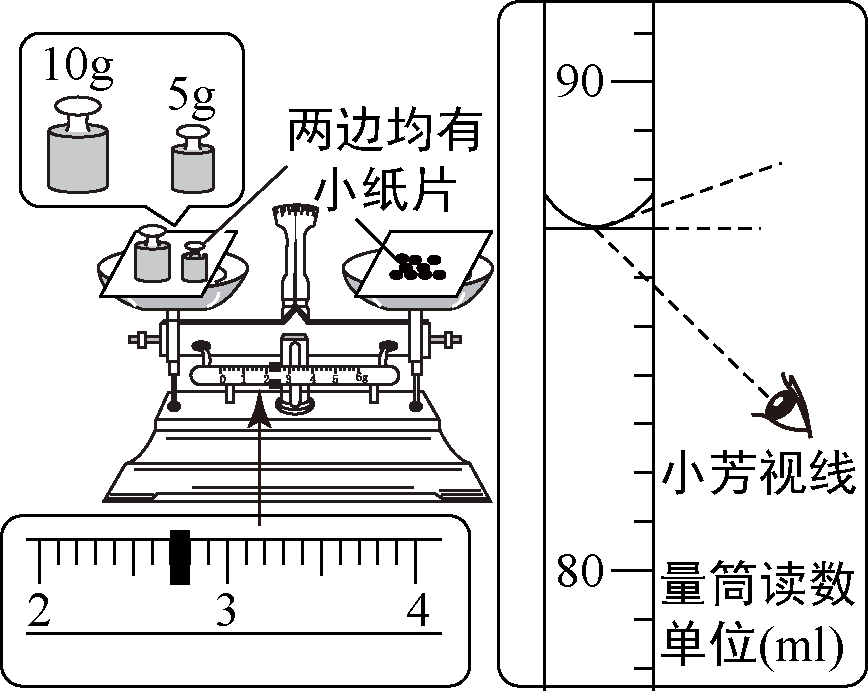
小芳用托盘天平称量时,将药品与砝码的位置放反了,使用的是 $10~\text{g}$ 和 $5~\text{g}$ 的砝码和 $2.7~\text{g}$ 的游码;由左盘的质量 $=$ 右盘的质量 $+$ 游码的质量可知:砝码质量 $=$ 药品质量 $+$ 游码的质量,所以药品质量 $=$ 砝码质量 $-$ 游码质量,即药品质量 $ = 10~\text{g} + 5~\text{g} - 2.7~\text{g} = 12.3~\text{g}$ 。
量取的水的实际体积为 $87~\text{mL}$ (合 $87~\text{g}$)。
小芳实际配制的氯化钠溶液的溶质质量分数为 $\frac{12.3~\text{g}}{12.3~\text{g}+87~\text{g}}\times 100\%\approx 12.4\%$ 。
故选A。
已知蔗糖的溶解能力随温度升高而变大。如图所示,20℃时将蔗糖加入一定量的水中静置。若要让试管中的蔗糖固体全部溶解,下列办法不可行的是()
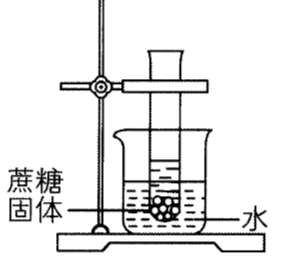
试管内加入适量水,采用的是增加溶剂的方法,可让蔗糖固体全部溶解;由于蔗糖的溶解能力随温度升高而变大,故烧杯内加入适量氢氧化钠固体,氢氧化钠溶于水放热,使温度升高,能让蔗糖固体全部溶解;同理,生石灰与水反应放出大量的热,使温度升高,能让蔗糖固体全部溶解;硝酸铵固体溶于水吸热,使温度降低,会析出更多的蔗糖晶体,不能让蔗糖固体全部溶解,故选选项D。
${{20}^{{}^\circ}}\text{C}$ 时,向 $50\text{g A}$ 溶液中加入 $~5\text {g A}$ 晶体,充分搅拌后,尚有部分晶体未溶解;稍加热后,晶体全部溶解。下列说法正确的是( )
${{20}^{{}^\circ}}\text{C}$ 时,向 $50\text{g A}$ 溶液中加入 $5\text{g A}$ 晶体,充分搅拌后,尚有部分晶体未溶解,此时溶液一定是饱和溶液;稍加热后,晶体全部溶解,得到的溶液可能是不饱和溶液,也可能恰好是此温度下的饱和溶液,故 A 正确。
故选 A 。
KNO3与KCl的溶解度曲线如图所示。下列说法正确的是()
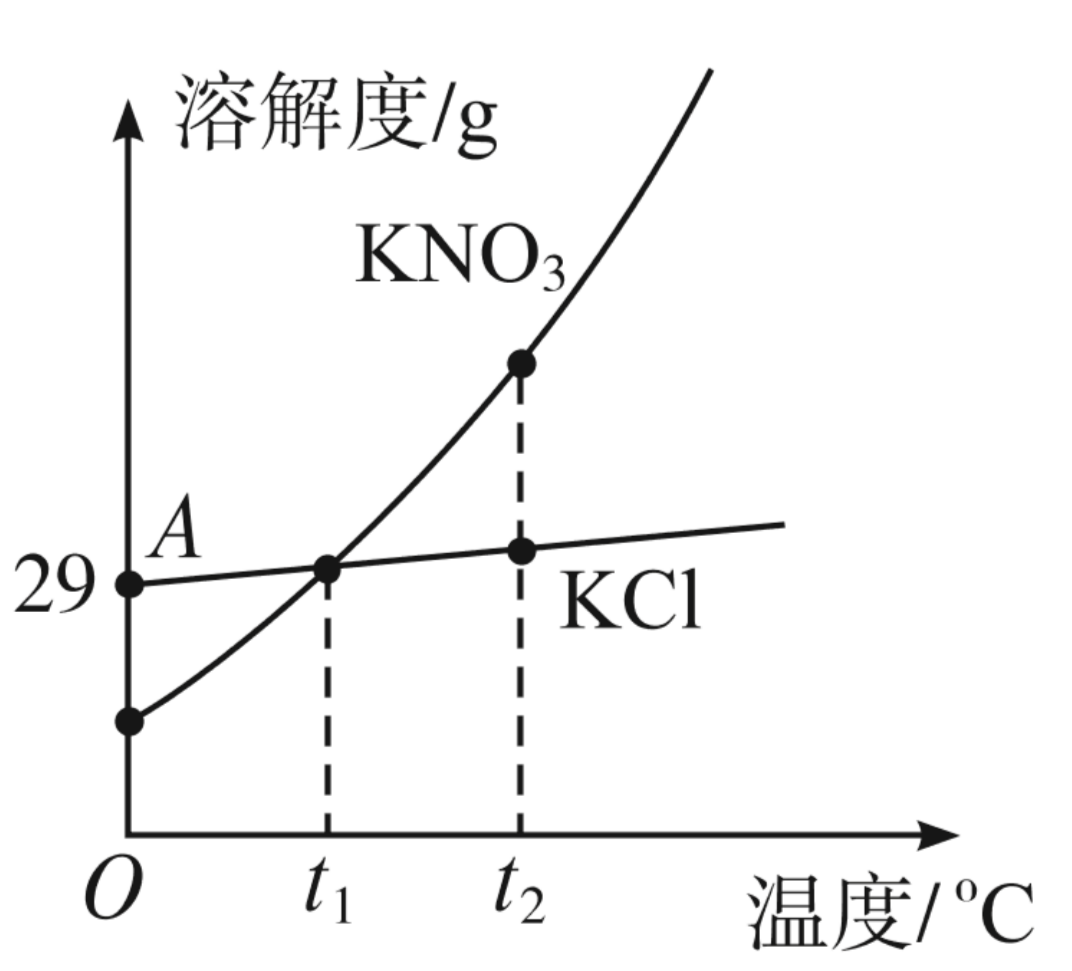
A.没有确定的温度,无法比较无知溶解度,错误;
B.氯化钾的溶解度随温度的升高而增大,所以t1温度下的氯化钾的饱和溶液升温至t2摄氏度,没有晶体析出,错误;
C.A点所表示的氯化钾的溶解度是29g,所以饱和溶液和溶液溶质质量分数=$\frac{29 g}{100 g+29 g} \times 100 \%=22.5 \%$,错误;
D.硝酸钾的溶解度受温度变化影响较大,所以冷却热的硝酸钾饱和蓉儿可获得硝酸钾晶体,正确;
故本题正确答案选D。
下列关于溶解度的说法正确的是( )
20℃时,把36g氯化钠放入64g水中,使其充分溶解(20℃时氯化钠的溶解度为36g)。对所得溶液的有关说法错误的是()
根据溶解度的概念,20℃时氯化钠的溶解度是36g,其含义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态。20℃时,把36g氯化钠放入64g水中,氯化钠不能全部溶解,该溶液是饱和溶液,选项1-正确;根据NaCI中$Na ^ {+}$和$Cl ^ {-}$的个数比为1∶1知,溶液中$Na ^ {+}$和$Cl ^ {-}$个数一定相等,选项2-正确;20℃时,64g水中最多溶解23.04g氯化钠,故该溶液的质量是87.04g,选项3-错误;该溶液的溶质与溶剂质量比为23.04∶64,化简后为9∶25,选项4-正确。
如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是()
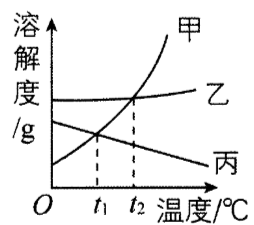
$t _ {1}$℃时,把甲的不饱和溶液变为饱和溶,,常用的方法为增加溶质或蒸发溶剂,若用蒸发溶剂的方法,则溶剂质量减少,故选项A错误;
根据溶解度曲线可知,$t _ {2}$℃时,甲、乙两种物质的溶解度相等,$t _ {2}$℃时溶质的质量分数$= \frac {\text {溶解度}} {\text {溶解度} + 100 g} \times 100 \%$,故选项B正确;
$t _ {1}$℃时,甲、乙、丙三种物质的溶解度大小关系为乙>甲=丙,其饱和溶液的溶质质量分数的大小关系为乙>甲=丙,升温到$t _ {2}$℃时,由于甲、乙的溶解度随温度的升高而增大,故甲、乙的质量分数没有变化,仍为乙>甲,而丙的溶解度随温度的升高而减小,故丙的质量分数小于甲,所以升温至$t _ {2}$℃时,三种溶液的溶质质量分数大小关系:乙>甲>丙,故选项C错误;
从溶解度曲线可以看出,甲的溶解度变化受温度影响比乙大,所以当甲中含有少量乙时,可采用降温结晶的方法提纯甲物质,故选项D错误。
某同学模拟闽籍化学家侯德榜的“侯氏制碱法”制纯碱,需用 $50.0~\text{g}$ 水配制 $20$ ${}^\circ \text{C}$ 的 $\text{NaCl}$ 饱和溶液($20$ ${}^\circ \text{C}$ 时 $\text{NaCl}$ 的溶解度为 $36.0~\text{g}$),应称取 $\text{NaCl}$ 的质量为( )
溶解度是在一定温度下,某固体溶质在 $100~\text{g}$ 溶剂里达到饱和状态所溶解的溶质质量。$20$ ${}^\circ \text{C}$ 时氯化钠的溶解度是 $36~\text{g}$,其涵义是 $20$ ${}^\circ \text{C}$ 时,$100~\text{g}$ 水中最多溶解 $36~\text{g}$ 氯化钠,则需用 $50.0~\text{g}$ 水配制 $20$ ${}^\circ \text{C}$ 的 $\text{NaCl}$ 饱和溶液,应称取 $\text{NaCl}$ 的质量为 $36~\text{g} \times \frac {{50~\text{g}}}{{100~\text{g}}} = 18~\text{g}$;
故选A。