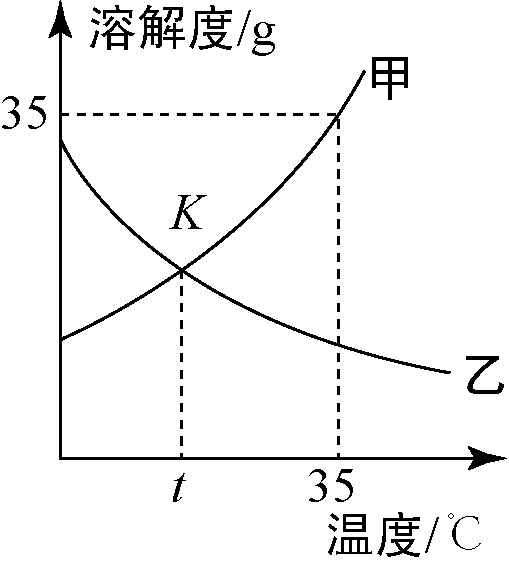
物质的溶解度随温度变化的曲线叫做溶解度曲线,利用溶解度曲线,可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如下图所示,下列说法不正确的是( )
题目答案
您的答案
答案解析
A.K点表示在t∘C时,甲、乙两种物质的溶解度相等,溶解度是建立在饱和溶液的基础上的,故A正确;
B.35∘C时,甲物质的溶解度是35 g,含义是该温度下100 g的水中最多能溶解35 g的甲物质,则50 g的水中最多能溶解17.5 g的甲物质,故将20 g甲物质加入50 g水中,充分溶解后得到的甲物质溶液质量是67.5 g,故B正确;
C.乙物质的溶解度随温度的升高而升高,故t∘C时乙物质的饱和溶液,升温到35∘C时仍是饱和溶液,故C正确;
D.当温度小于t∘C时,乙物质的溶解度大于甲物质的溶解度,当温度大于t∘C时,乙物质的溶解度小于甲物质的溶解度,故D错误;
故选D。
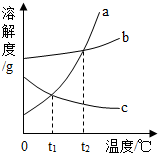 溶解度曲线是物质溶解性的直观体现,如图是a,b,c三种物质的溶解度曲线,下列说法正确的是( )
溶解度曲线是物质溶解性的直观体现,如图是a,b,c三种物质的溶解度曲线,下列说法正确的是( )