黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10$g$粉末状黄铜样品放入烧杯中,量取45$mL$稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如下表:
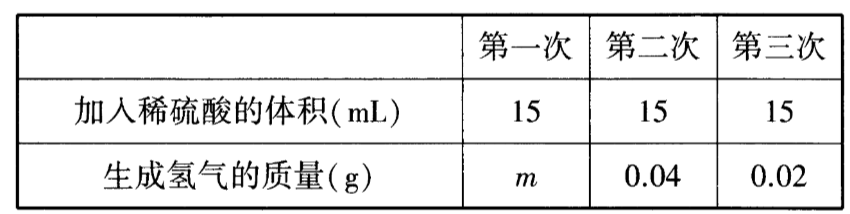
黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10$g$粉末状黄铜样品放入烧杯中,量取45$mL$稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如下表:

m的数值是。
由第二次、第三次实验数据可知,15$mL$稀硫酸完全反应生成氢气质量是0.04$g$,因此m的数值是0.04。
此黄铜样品中铜的质量分数是多少?(写出计算过程)
解:设黄铜样品中锌的质量为x
反应生成氢气质量:$0.04 g + 0.04 g + 0.02 g = 0.1g$

样品中铜的质量分数是$\frac {10 g - 3.25 g} {10 g} \times 100 \% = 67.5 \%$
答:此黄铜样品中铜的质量分数是$67.5 \%$。
合金中的锌完全反应,生成氢气质量为$0.04 g + 0.04 g + 0.02 g =$$0.1 g$,根据锌与稀硫酸反应的化学方程式,由氢气的质量可以计算出锌的质量,从而可以计算黄铜样品中铜的质量分数。
按要求写出下列反应的化学方程式。
为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
 | 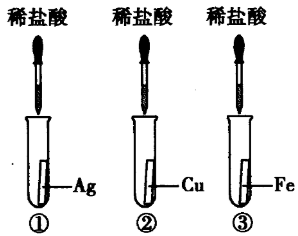 |
验证三种金属的活动性时,可采取“三取中”的方法一次性完成验证。若排在中间的金属选用单质,则两边的金属选用它们的化合物溶液;若选用排在中间金属的化合物溶液,则两边的金属选用单质。
方案A:实验中铁和硫酸铜反应生成硫酸亚铁和铜,说明铁的活动性大于铜;银不能与硫酸铜反应,说明铜的活动性大于银,能比较三种金属的活动性。方案B:实验中铁能与稀盐酸反应,铜、银均不能与稀盐酸反应,说明铁的金属活动性大于铜和银,但不能比较铜和银的活动性强弱。
“去除粗盐中难溶性杂质”的实验操作如下图所示。

以下金属的用途主要利用了金属的哪个物理性质?
把 $7\text{g}$ 含杂质的锌片(杂质不与盐酸反应)投入 $100\text{g}$ 足量的稀盐酸里,反应停止后所得混合物的总质量为 $106.8\text{g}$。计算:
将 $6.8$ $\rm g$ 含杂质的锌粒加入到 $80$ $\rm g$ 过量的稀硫酸中(杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为 $86.3$ $\rm g$。试计算:
某钢铁公司日产含杂质 $5\%$ 的生铁 $\rm 3000\ t$。试计算:
课内阅读我能行。春风吹 夏雨落 秋霜降 冬雪飘
课内阅读我能行。池草青 山花红 鱼出水 鸟入林
课外阅读我最棒。 春风送暖,冰雪融化,小草偷偷地从地里钻出来,大地披上了绿色的新装。柳树发了芽,果树开了花。小鸟在枝头歌唱,蝴蝶在花间飞舞。啊,它们在美好的春光里多么快活呀()