[多选]向一定质量AgNO$_3$和Cu(NO$_3$)$_2$的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )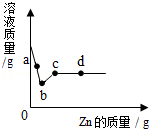
题目答案
您的答案
答案解析
分析:
根据金属与盐溶液的反应进行分析,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,且置换时先把最弱的金属置换出来,并通过各反应的关系进行溶液质量的变化分析.
解答:
解:在金属活动性顺序中,Zn>Cu>Ag,向一定质量AgNO$_3$和Cu(NO$_3$)$_2$的混合溶液中加入Zn,与两种溶质依次发生反应
Zn+2AgNO$_3$=Zn(NO$_3$)$_2$+2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn+Cu(NO$_3$)$_2$=Zn(NO$_3$)$_2$+Cu
65 64
所以析出铜的过程是溶液质量增加的过程
A、在a点时,硝酸银没有全部参加反应,溶液中含有硝酸银、硝酸铜和生成的硝酸锌,溶质是三种,故A正确;
B、c点时硝酸铜恰好完全反应,溶液中只有硝酸锌,故B错误;
C、b~c段是硝酸银全部参加反应完后锌和硝酸铜反应的过程,因此滴加稀盐酸,不会产生沉淀,故C错误;
D、d点时锌过量,因此加入稀盐酸会产生氢气,故D正确;
故选AD.
点评:
本题考查了金属活动性顺序的应用,要求学生熟悉金属的活动性顺序表,能利用活动性判断反应的发生,还要结合坐标分析各段的意义.