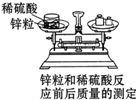
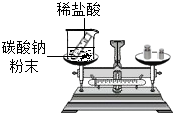
质量守恒定律是化学反应、乃至自然界最基本的定律之一,依据质量守恒定律我们可以精确地研究化学反应.最早传播和用文字记载并使人们普遍接受质量守恒定律的科学家是( )
题目答案
您的答案
答案解析
分析:
根据科学家们各自在科学上做出的贡献进行分析解答本题.
解答:
解:A、拉瓦锡首先通过化学实验证明了化学反应中质量守恒定律,传播和用文字记载并使人们普遍接受质量守恒定律,故选项正确.
B、早在17世纪,质量守恒定律发现之前,英国化学家波义耳曾经做过一个实验:在密闭的容器中燃烧金属时,得到了金属灰,然后打开容器盖,称量金属灰的质量,发现比原来金属质量增加了.这种变化并没有引起波义耳的足够重视,也因此错过了一次取得重要科研成果的机会,故选项错误.
C、1897年,汤姆生发现了电子,故选项错误.
D、卢瑟福领导团队成功地证实在原子的中心有个原子核,创建了卢瑟福模型(行星模型).他最先成功地在氮与α粒子的核反应里将原子分裂,他又在同实验里发现了质子,并且为质子命名.第104号元素为纪念他而命名为“鑪”.故选项错误.
故选A.
点评:
本题很简单,了解化学的发展历史,关注化学学科成就,有利于激发学生学习化学的兴趣,培养学生的社会责任感