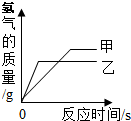
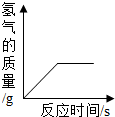
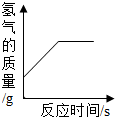
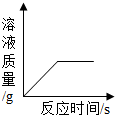
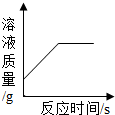
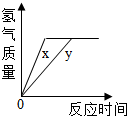
(多选)往一定量的稀硫酸中加入过量的锌粒,如图是反应过程中某种量Y随加入锌粒的质量变化的关系,则Y不可能表示( )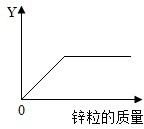
题目答案
您的答案
答案解析
分析:
通过锌与稀硫酸反应的化学方程式分别估算锌粉、硫酸锌、氢气和溶液的总质量,再分别让锌粉的质量、硫酸锌的质量、氢气的质量和溶液的总质量在反应开始时、反应进行中和反应结束后对应在坐标系中,就能得出相应的图象,再与所给图象对照,即可得到答案.
解答:
A、稀硫酸能与锌反应生成硫酸锌和氢气,所以硫酸会不断被消耗,则硫酸的质量分数会不断变小,直至最终变为0,所以该图不符合.
B、硫酸锌在反应开始时的质量为零,反应中硫酸锌的质量逐渐增加,由于锌过量,因此当硫酸全部反应后,硫酸锌的质量就增加到最大值,从而不再变化,所以对应的图象应该是一条从原点出发,先上升,再保持水平的一条曲线.所以该图符合.
C、硫酸的溶液呈酸性硫酸锌的溶液呈中性,所以随着硫酸不断变小,溶液的酸性会不断变弱,pH会不断升高,直至硫酸消耗完后,溶液呈中性pH=7不再变化,但溶液的pH一开始不会为0;
D、氢气在反应开始时的质量为零,反应中氢气的质量逐渐增加,由于锌过量,因此当硫酸全部反应后,氢气的质量就增加到最大值,从而不再变化,所以对应的图象应该是一条从原点出发,先上升,再保持水平的一条曲线.所以该图符合;
故选:A、C;
点评:
解答这类题的关键是,读懂图象本意,审清图象内涵.准确理解并应用图象中的相关信息,从而才能够正确解题.