A、B、C、D四种物质在一定条件下发生如下反应:2A+3B=2C+2D,已知A、B、C、D的相对分子质量依次为M1、M2、M3、M4;当它们恰好完全反应时,A、B、C、D的质量比为m1∶m2∶m3∶m4,则下列关系式中不正确的是( )
题目答案
您的答案
答案解析
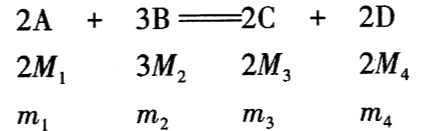
则m1m2=2M13M2,m1m4=2M12M4=M1M4,故选项A错,选项B正确;根据质量守恒定律可知选项C、选项D均正确。
A、B、C、D四种物质在一定条件下发生如下反应:2A+3B=2C+2D,已知A、B、C、D的相对分子质量依次为M1、M2、M3、M4;当它们恰好完全反应时,A、B、C、D的质量比为m1∶m2∶m3∶m4,则下列关系式中不正确的是( )
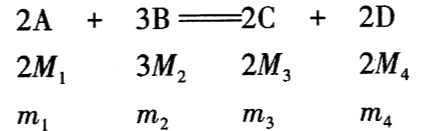
则m1m2=2M13M2,m1m4=2M12M4=M1M4,故选项A错,选项B正确;根据质量守恒定律可知选项C、选项D均正确。
在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
A | b | C | D | |
反应前质量(g) | 8 | 10 | 1 | 25 |
反应后质量(g) | 未测 | 24 | 2 | 16 |
若A的相对分子质量为2n,D的相对分子质量为3n,则该反应的化学方程式中A与D的化学计量数之比为( )
分析表中数据可知,B、C质量增加,即B、C为生成物,增加的质量为$( 24 g - 10 g ) + ( 2 g - 1 g ) = 15 g$;D物质质量减少,为反应物,减少的质量为$25 g - 16 g = 9 g$;根据质量守恒定律,参加反应的物质的总质量等于生成的物质的总质量可知,A物质应为反应物,且参加反应的A物质的质量为$15 g - 9 g = 6 g$。该反应的化学方程式可表示为$aA + dD \stackrel { \text { 高温 } } { = } bB + cC$,要求A、D的化学计量数之比,可根据化学方程式计算如下:
$aA + dD \stackrel { \text { 高温 } } { = } bB + cC$
2na3nd
6g9g
$\frac {2 n a} {3 n d} = \frac {6} {9}$,解得:$\frac {a} {d} = \frac {1} {1}$。
能根据化学方程式进行计算的理由是( )
化学方程式中反映出了各物质之间的质量关系,且参加反应的各物质的质量比一定,故可用于计算。
在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 4 | 6 | 3 | 20 |
反应后的质量/g | 0 | 8 | 17 | 待测 |
已知甲和丁的相对分子质量之比为1∶3,下列推理正确的是( )
反应后减少的质量即参加反应的质量,增加的质量即反应生成的质量,由此得出∶甲为反应物,参加反应的质量为4g;乙为生成物,生成2g;丙为生成物,生成14g。根据质量守恒定律判断出∶丁为反应物,参加反应的质量为2g+14g−4g=12g,故丁反应后的质量为20g−12g=8g。根据以上判断可知选项1-、选项2-、选项3-错误。设甲、乙、丙、丁的化学计量数分别为a、m、n、b。
a 甲 +b 丁→m乙+n丙
ab×3
4g 12g
a3b=4g12g
ab=11
故选项4-选项正确。
物质X在4.8g氧气中恰好完全燃烧,反应方程式为$X + 30 _ {2} \stackrel {{点燃}} {=} R O _ {2} + 2 S O _ {2}$,测得RO2和SO2的质量分别为2.2g和6.4g。下列判断中正确的是( )
根据质量守恒定律可知,参加反应的X的质量为(2.2g+6.4g)-4.8g=3.8g,故选项1-不正确;反应中X、O2的质量比为3.8g∶4.8g,结合反应的化学方程式可计算出X的相对分子质量为76,故选项2-正确;根据反应前后氧原子的数目不变可知,X中不含O元素,故选项3-不正确;设R的相对原子质量为x,则$\frac {x + 32} {128} = \frac {2.2 g} {6.4 g}$,解得x=12,所以R为碳元素,RO2为二氧化碳,其不属于空气污染物,故选项4-不正确。
石墨烯是一种革命性材料,具有优异的光学、电学和力学特性。下图为金刚石、石墨和石墨烯的结构模型图,图中小球代表碳原子。下列说法正确的是( )

①石墨烯是一种新型化合物
②三种物质分别在足量的氧气中完全燃烧的产物相同
③金刚石和石墨烯是组成相同但结构不同的两种物质
④石墨烯有超强的导电性和导热性,说明石墨烯的化学性质和金属相似
考查碳元素形成的单质及它们的物理性质是否相似等内容。解此类题要明确金刚石、石墨和C60物理性质有很大差异的原因是碳原子的排列方式不同,以及物质的结构决定物质的性质,物质的性质决定物质的用途的辩证关系。
石墨烯是一种由碳元素组成的单质,①错误;这三种物质都是由碳元素组成的单质,完全燃烧后的产物都是CO2,②正确;金刚石和石墨烯的组成元素都是碳,即组成相同,但碳原子排列方式不同,即结构不同,③正确;导电性和导热性属于物质的物理性质,石墨烯的物理性质和金属相似,④错误。综上所述,说法正确的是②③。
碳还原氧化铜的实验如图所示,实验结束时将导管从石灰水中取出后停止加热,冷却至室温。相关分析正确的是( )
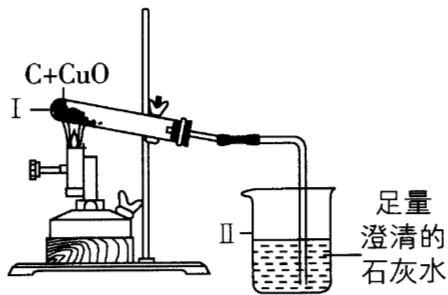
选项1-项,在木炭还原氧化铜的实验中,装置内的空气受热膨胀,装置Ⅱ中也会出现气泡,不能说明Ⅰ中反应已开始,故选项1-错误;选项2-项,由于在高温条件下,碳与氧化铜反应生成了铜和二氧化碳,二氧化碳和碳在高温的条件下反应生成一氧化碳,反应中,装置Ⅰ减少的质量不是氧元素的质量,故选项2-错误;选项3-项,冷却后,若装置Ⅰ中有黑色固体,可能是碳有剩余,也有可能是氧化铜有剩余,也有可能是冷却至室温,部分空气会进入试管与热的铜反应生成了氧化铜,故选项3-错误;选项4-项,由题意可知,实验结束时将导管从石灰水中取出后停止加热,冷却至室温,部分空气会进入试管,会与热的铜反应生成了氧化铜,冷却后,装置Ⅰ减少的质量小于生成气体的质量,故选项4-正确。
当氧化铜中混有少量炭粉时,提纯的方法是( )
在氧气流中,碳与氧气反应生成二氧化碳气体,从而可以除去氧化铜中混有的炭粉。
如图是木炭还原氧化铜反应的实验装置图,下列说法正确的是( )
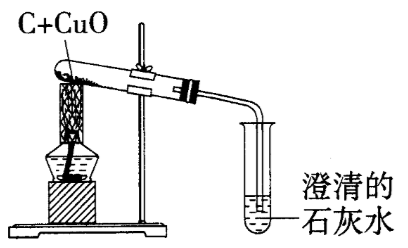
通过木炭与氧化铜反应说明碳具有还原性。综合考查木炭还原氧化铜的相关知识。掌握反应的实验现象、实验原理及有关的注意事项是解此类题的关键。
实验过程中,可观察到黑色粉末逐渐变红,选项2-错误;木炭能把氧化铜还原为铜,具有还原性,选项3-错误;实验结束后,应先将导气管从澄清的石灰水中撤出,再停止加热,以防止试管中的石灰水倒流,炸裂试管,选项4-错误。
实验室制取气体过程中发生装置的选择依据是( )
实验室制取气体的装置包括发生装置和收集装置两部分,发生装置的选择依据是反应物的状态和反应条件,故选项4-正确。
化学学习中要构建许多基本观念,以下对化学基本观念的认识不正确的是( )
物质由元素组成,一氧化碳和二氧化碳都是由碳、氧元素组成的,选项1- 正确;3g碳完全转化成二氧化碳所需氧气的质量为8g,选项2- 错误;一氧化碳在点燃的条件可以与氧气反应生成二氧化碳,选项3- 正确;一氧化碳与二氧化碳化学性质不同,原因是它们的分子构成不同,选项4- 正确。