下列合金(金属)的比较,其中不正确的是( )
题目答案
您的答案
答案解析
合金的特点是熔点低、硬度大、耐腐蚀,故D错误。
故选D。
下列合金(金属)的比较,其中不正确的是( )
合金的特点是熔点低、硬度大、耐腐蚀,故D错误。
故选D。
下列物质在一定条件下能与氧气反应,且生成物为黑色固体的一组是()
①$Mg$ ②$Al$ ③$Fe$ ④$Au$ ⑤$Cu$
所给五种物质中仅有Au不与氧气发生反应,而能与氧气发生反应的其他四种物质中铁和铜与氧气反应可得到黑色固体。
下列关于金属与氧气反应的说法中正确的是( )
红热的铁丝在空气中不能燃烧,A错误;不活泼的金属如金,在常温下不能与氧气反应,B错误;金属越活泼,越易与氧气反应,可根据金属与氧气反应的难易程度,初步比较不同金属的活动性,C正确;在较高温度下铜能与氧气反应,但在常温下两者不发生反应,D错误。
下列说法正确的是()
镁燃烧发出耀眼的白光,常用于制作烟花,选项1-正确;通常情况下铝制品耐腐蚀,是因为铝易与空气中的氧气反应,在其表面生成一层致密的氧化铝薄膜,防止内层金属继续被氧化,选项2-错误;可燃物的着火点一般是固定不变的,用水灭火是因为水可以将可燃物的温度降到着火点以下,选项3-错误;过氧化氢溶液分解生成水和氧气,属于化学变化,分离液态空气制氧气属于物理变化,选项4-错误。
收藏家收藏的清末铝制品,至今保存完好,该艺术品不易锈蚀的主要原因是( )
铝能被空气中的氧气氧化,在其表面生成一层致密的氧化膜,起到保护作用,使内部的铝不易被腐蚀,因此铝制品能够长久保存,故D正确;
故选D。
“真金不怕火炼”能体现金具有的性质是( )
“真金不怕火炼”说明金在高温条件下也不容易与氧气发生化学反应。体现了金的热稳定性强。属于金的化学性质。该说法与金的熔点、密度和导电性没有直接关系。
故选D。
将一根洁净的铁钉放人稀硫酸中,下列预测可能不正确的是( )
铁能与稀硫酸反应生成硫酸亚铁与氢气,所以铁钉表面将产生气泡,溶液由无色变为浅绿色;由于溶解的铁的质量大于生成氢气的质量,所以溶液质量将增加;铁钉表面不会出现铁锈。
如图所示的四个图像,分别对应四种过程,其中正确的是( )
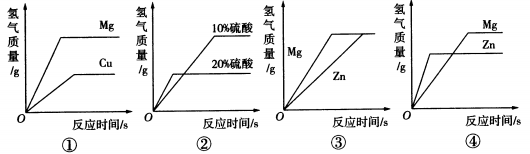
Cu不能与稀硫酸反应,与稀硫酸混合不会产生氢气,A错误;等质量、不同浓度的稀硫酸,浓度大的稀硫酸所含的氢元素质量大,等质量的稀硫酸与等质量且足量的Zn反应时,酸完全反应,所以稀硫酸浓度越大产生的氢气越多,B错误;等质量、等浓度的稀硫酸与等质量且足量的Mg、Zn反应,产生氢气的质量相等,且Mg比Zn活泼,反应速率快,C正确;等质量的Mg和Zn与等质量、等浓度且足量的稀硫酸反应,Mg产生的氢气比Zn多,且Mg比Zn活泼,反应速率快,D错误。

相同质量的$Mg、Fe、Zn$三种金属,分别与足量的、质量相同、质量分数相同的稀$H _ {2} SO _ {4}$充分反应,生成氢气与消耗稀$H _ {2} SO _ {4}$的质量关系如图。分析图像所得的结论中,不正确的是()
图像的横坐标为稀硫酸质量,由图中信息不能判断三种金属的活动性顺序,故选项1-错误;三种金属和稀硫酸反应生成的硫酸盐中金属元素的化合价都是﹢2,因为参加反应的三种金属的质量相同,所以生成氢气质量越小,金属的相对原子质量越大,由图中信息可知,生成氢气质量由小到大的顺序是锌、铁、镁,因此三种金属的相对原子质量:$Mg<Fe<Zn$,故选项2-正确;生成氧气质量越大,消耗稀硫酸质量越大,因此三种金属消耗稀$H _ {2} SO _ {4}$的质量:$Mg>Fe>Zn$,故选项3-正确;由题意可知,加入稀硫酸的质量相等,参加反应的三种金属的质量相同,则生成氢气质量越大,反应后形成溶液的质量越小,因此三种金属与稀$H _ {2} SO _ {4}$反应后溶液的质量:$Mg<Fe<Zn $,故选项4-正确。
相同质量的$Mg$、$Fe$分别与稀盐酸反应,产生氢气的质量$m(H _ {2})$与加人稀盐酸的体积$V$(稀盐酸)关系如下所示,其中正确的是( )
(1)等质量金属与足量的酸反应

图8-2-1
图8-2-1图反映出:
①金属越活泼,曲线越陡。
②当金属在化合物中化合价相同时,金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高。
(2)足量的金属与等量的酸反应
金属是足量的,说明酸完全反应,最终生成氢气的质量相等。如图8-2-2:

图8-2-2
$Mg$和$Fe$都能和盐酸反应,当酸过量,相同质量的两种金属完全反应时,$Mg$和稀盐酸反应得到的氢气质量多;当参加反应的酸不足时,生成的氢气质量应该相等,所以图像选项D正确。
下列物质中,能由金属跟盐酸直接反应制取的是()
铁与盐酸反应的产物为氯化亚铁;不是氯化铁,选项A错误;
银不能置换出盐酸中的氢,无法生成$AgCl$,选项B错误;
锌能与盐酸反应生成氯化锌,选项C正确;
铜不能置换出盐酸中的氢,无法生成$CuCl _ {2}$,选项D错误。