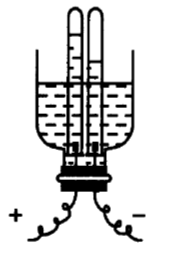
如图所示是用家庭中的物品制成的电解水的装置,下列有关说法中错误的是( )
题目答案
您的答案
答案解析
电解水生成氧气和氢气的体积之比约是1∶2;水中加入少量氢氧化钠的目的是增强导电性;与正极相连的试管中收集到的气体是氧气,氧气具有助燃性,能使带火星的木条复燃:电解水生成了氢气和氧气,说明水是由氢元素和氧元素组成的。
如图所示是用家庭中的物品制成的电解水的装置,下列有关说法中错误的是( )

电解水生成氧气和氢气的体积之比约是1∶2;水中加入少量氢氧化钠的目的是增强导电性;与正极相连的试管中收集到的气体是氧气,氧气具有助燃性,能使带火星的木条复燃:电解水生成了氢气和氧气,说明水是由氢元素和氧元素组成的。
某物质经分析只含有一种元素,则该物质不可能是( )
根据纯净物、混合物、单质、氧化物的定义可知,只含有一种元素的物质有可能是混合物,也有可能是纯净物,如果是纯净物则是单质,但因只含有一种元素,故一定不是化合物或氧化物,故选项D正确。
下列符号表示氢气化学式的是( )
选项1-项表示氢元素或者一个氢原子;选项2-项表示氢离子;选项3-项为氢气的化学式;选项4-项表示两个氢原子。
元素R的氧化物的化学式为R2O3,若R的化合价不变,下列化学式错误的是()
化合物中各元素正、负化合价代数和为0,元素R的氧化物的化学式为R2O3,氧元素显﹣2价,设R的化合价为x,则$2 x + ( - 2 ) \times 3 = 0$,$x = + 3$。硫酸根显﹣2价,硝酸根显﹣1价,氯元素显﹣1价,氢氧根离子显﹣1价,若R的化合价不变,R和氯元素形成的化合物为$RCl _ {3}$,选项3-错误。
如图是通过白磷燃烧来验证质量守恒定律的实验,下列说法错误的是( )
A、锥形瓶内的白磷和氧气不一定恰好完全反应,如果恰好完全反应,则反应前锥形瓶内白磷和氧气的总质量一定等于反应后生成五氧化二磷的质量,如果不是恰好完全反应,则反应前锥形瓶内白磷和氧气的总质量一定大于反应后生成五氧化二磷的质量,该选项说法错误;B、白磷燃烧结束,锥形瓶应冷却后再放在天平上称量,该选项说法正确;C、白磷燃烧放出热量,锥形瓶中的气体膨胀,冷却后气体收缩,因此实验过程中气球先变大后变瘪,该选项说法正确;D、瓶底的细砂起隔热作用,该选项说法正确.故选:A.
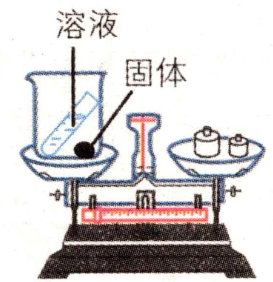
用如图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
质量守恒定律是化学变化所遵循的普遍规律,在进行验验证时,应注意两点:
①药品能发生化学反应;
②应分别称量反应前后的所有反应物、生成物的质量,故有气体参加或产物会逸散的反应,必须在密闭容器中进行。
双氧水在二氧化锰催化作用下分解生成氧气,氧气从烧杯中逸出,故反应后天平不平衡,选项1-错误;碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳气体会逸出,故反应后天平不平衡,选项2-错误;铁和硫酸铜反应生成硫酸亚铁和铜,化学反应前后的各物质均在烧杯中,故反应后天平平衡,能验证质量守恒定律,选项3-正确;氯化钠和水不能发生化学反应,故不能验证化学变化所遵循的质量守恒定律,选项4-错误。
厉害了,我的国!我国航天技术迅猛发展,“天舟一号”与在轨运行的“天宫二号”空间实验室首次成功交会对接,有力推动了我国空间站建设的进程。空间站里的O2源自电解水,所得H2与CO2反应生成H2O和CH4,该反应的微观示意图如图所示。依据图示,下列叙述错误的是( )
化学反应的过程就是参加反应的各物质(反应物)的原子重新组合成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
化学变化的实质是反应物的分子分裂成原子,原子重新组合成新的分子,反应前后元素种类不变,原子的种类、数目、质量都不变;物质的种类、分子的种类一定发生变化。
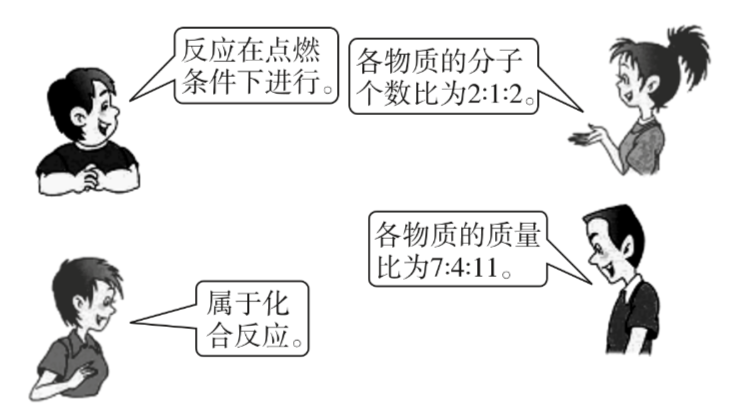
下图中四位同学正在讨论某一化学方程式表示的意义,他们描述的化学方程式是( )
三要点:
明确化学方程式的宏观意义;
能根据化学方程式求解各物质的质量比;
明确化学方程式的微观意义。
本题是有关化学方程式表示意义的开放性试题。解题时,要从质的方面和量的方面逐一分析化学方程式表示的意义,筛选出符合要求的化学方程式。根据四位同学的描述,该反应是化合反应,排除选项4-项;各物质的分子个数比为 2∶1∶2,排除选项1-项;各物质的质量比为 7∶4∶11,排除选项3-项。
下列化学反应可用下图表示的是( )
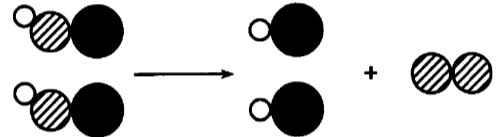
从图中可以看出,该反应属于分解反应,生成物为一种化合物和一种单质,根据这一特征可知正确答案为选项3-。
A、B、C、D四种物质在一定条件下发生如下反应:2A+3B=2C+2D,已知A、B、C、D的相对分子质量依次为M1、M2、M3、M4;当它们恰好完全反应时,A、B、C、D的质量比为m1∶m2∶m3∶m4,则下列关系式中不正确的是( )
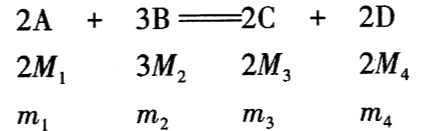
则m1m2=2M13M2,m1m4=2M12M4=M1M4,故选项A错,选项B正确;根据质量守恒定律可知选项C、选项D均正确。
在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
A | b | C | D | |
反应前质量(g) | 8 | 10 | 1 | 25 |
反应后质量(g) | 未测 | 24 | 2 | 16 |
若A的相对分子质量为2n,D的相对分子质量为3n,则该反应的化学方程式中A与D的化学计量数之比为( )
分析表中数据可知,B、C质量增加,即B、C为生成物,增加的质量为$( 24 g - 10 g ) + ( 2 g - 1 g ) = 15 g$;D物质质量减少,为反应物,减少的质量为$25 g - 16 g = 9 g$;根据质量守恒定律,参加反应的物质的总质量等于生成的物质的总质量可知,A物质应为反应物,且参加反应的A物质的质量为$15 g - 9 g = 6 g$。该反应的化学方程式可表示为$aA + dD \stackrel { \text { 高温 } } { = } bB + cC$,要求A、D的化学计量数之比,可根据化学方程式计算如下:
$aA + dD \stackrel { \text { 高温 } } { = } bB + cC$
2na3nd
6g9g
$\frac {2 n a} {3 n d} = \frac {6} {9}$,解得:$\frac {a} {d} = \frac {1} {1}$。