下列离子方程式中,属于水解反应的是( )
题目答案
您的答案
答案解析
分析:
弱离子水解反应的实质是:弱离子和水电离出的氢离子或氢氧根离子结合生成弱电解质的过程,水解方程式用可逆号.
解答:
解:A、是甲酸的电离方程式,故A错误;
B、是碳酸的一级电离方程式,故B错误;
C、是碳酸根的水解方程式,故C正确;
D、是硫氢根离子的电离方程式,故D错误.
故选C.
点评:
本题考查学生水解方程式的书写和水解原理知识,可以根据所学知识来回答,难度不大.
下列离子方程式中,属于水解反应的是( )
分析:
弱离子水解反应的实质是:弱离子和水电离出的氢离子或氢氧根离子结合生成弱电解质的过程,水解方程式用可逆号.
解答:
解:A、是甲酸的电离方程式,故A错误;
B、是碳酸的一级电离方程式,故B错误;
C、是碳酸根的水解方程式,故C正确;
D、是硫氢根离子的电离方程式,故D错误.
故选C.
点评:
本题考查学生水解方程式的书写和水解原理知识,可以根据所学知识来回答,难度不大.
下列离子方程式中属于水解反应,而且可使溶液呈酸性的是( )
分析:
弱离子水解反应的实质是:弱离子和水电离出的氢离子或氢氧根离子结合生成弱电解质的过程,水解方程式用可逆号,溶液显示酸性,则氢离子浓度大于氢氧根浓度.
解答:
解:A、是硫氢根离子的电离方程式,故A错误;
B、是亚硫酸氢根离子的电离方程式,故B错误;
C、是碳酸氢根的电离方程式,故C错误;
D、是铵根离子的水解方程式,溶液显示酸性,故D正确.
故选D.
点评:
本题考查学生水解方程式的书写和水解原理知识,可以根据所学知识来回答,难度不大.
下列变化属于水解反应的是( )
①NH$_3$+H$_2$O⇌NH$_4$_+OH_
②HCO$_3$_+H$_2$O⇌H$_2$CO$_3$+OH_
③NH$_4$_+2H$_2$O⇌NH$_3$•H$_2$O+H$_3$O_
④Al_+3HCO$_3$_=Al(OH)$_3$↓+3CO$_2$↑
⑤AlO$_2$_+HCO$_3$_+H$_2$O=Al(OH)$_3$↓+CO$_3$_
⑥HCO$_3$_+H$_2$O⇌H$_3$O_+CO$_3$_.
分析:
水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答:
解:①氨气和水反应生成NH$_3$•H$_2$O,NH$_3$•H$_2$O⇌NH$_4$_+OH_是一水合氨的电离方程式,故①错误;
②碳酸氢根离子结合水电离出的氢离子生成碳酸和氢氧根离子,是碳酸氢根离子的水解,故②正确;
③铵根离子结合水电离出的氢氧根离子生成一水合氨和水合氢离子,是铵根离子的水解,故③正确;
④铝离子结合水电离出的氢氧根离子生成氢氧化铝和氢离子,碳酸氢根离子结合水电离出的氢离子生成碳酸和氢氧根离子,两者相互促进水解,生成氢氧化铝沉淀和二氧化碳气体,故④正确;
⑤HCO$_3$_电离出氢离子和CO$_3$_,AlO$_2$_结合氢离子生成氢氧化铝沉淀,是复分解反应,故⑤错误;
⑥HCO$_3$_电离为氢离子和CO$_3$_,HCO$_3$_+H$_2$O⇌H$_3$O_+CO$_3$_,是HCO$_3$_的电离方程式,故⑥错误;
故选B.
点评:
本题考查学生对水解反应原理的理解,难度不大,明确水解的反应原理是解答本题的关键,注意区分水解和电离.
下列各表达式中,属于水解反应的是( )
分析:
弱酸根离子或弱碱根离子结合水电离的氢离子或氢氧根离子生成弱酸或弱碱,导致溶液显示碱性或酸性,此类反应属于水解反应,据此对各选项进行判断.
解答:
解:A.HCO$_3$_+H$_2$O⇌H$_3$O_+CO$_3$_为碳酸氢根的电离方程式,不属于水解反应,故A错误;
B.铵根离子水解生成一水合氨和氢离子,水解方程式为:NH$_4$_+H$_2$O⇌NH$_3$•H$_2$O+H_,故B错误;
C.亚硫酸氢根离子水解生成亚硫酸和氢氧根离子,其水解的离子方程式为:HSO$_3$_+H$_2$O⇌H$_2$SO$_3$+OH_,故C正确;
D.水为弱电解质,H$_2$O+H$_2$O⇌H$_3$O_+OH_为水的电离方程式,故D错误;
故选C.
点评:
本题考查了水解原理、离子方程式的判断,题目难度不大,试题侧重基础知识的考查,注意掌握盐的水解原理、弱酸根或弱碱根离子水解的离子方程式的书写方法,明确电离方程式与水解方程式的区别.
常温下,稀释0.1mol•L_ Na$_2$CO$_3$溶液,图中的纵坐标可以表示( )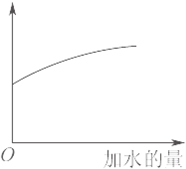
分析:
A、水解的平衡常数只与温度有关;
B、加水稀释,溶液中氢氧根离子浓度减小;
C、D、加水稀释,碳酸根离子水解平衡正移;
解答:
解:A、水解的平衡常数只与温度有关,加水稀释平衡常数不变,故A错误;
B、加水稀释,溶液的体积增大,溶液中氢氧根离子浓度减小,所以稀释过程中溶液pH应逐渐减小,故B错误;
C、D、稀释过程中水解平衡CO$_3$_+H$_2$O⇌HCO$_3$_+OH_向右移动,所以HCO$_3$_数目增大,CO$_3$_数目减少,c(CO$_3$)减小,故C正确、D错误;
故选C.
点评:
本题考查了影响盐类水解的因素,水解平衡常数只受温度影响,本题难度不大.
下列有水参加的化学反应中,不属于水解反应的是( )
分析:
A、反应中是铵根离子水解的反应;
B、反应中是碳酸氢根离子电离的方程式,水是生成水合氢离子,不属于水解反应;
C、铝离子水解生成氢氧化铝和氢离子;
D、醋酸根离子水解生成醋酸和氢氧根离子.
解答:
解:A、NH$_4$_+H$_2$O⇌NH$_3$•H$_2$O+H_,铵根离子水解生成一水合氨和氢离子,水参加反应,故A不符合;
B、HCO$_3$_+H$_2$O⇌H$_3$O_+CO$_3$_,是碳酸氢根离子电离方程式,水是生成水合氢离子,不是水解,故B符合;
C、Al_+3H$_2$O⇌Al(OH)$_3$+3H_是铝离子水解反应,水参与反应,故C不符合;
D、CH$_3$COO_+H$_2$O⇌CH$_3$COOH+OH_,醋酸根离子水解生成醋酸和氢氧根离子,水参与反应,故D不符合;
故选B.
点评:
本题考查了盐类水解分析判断,电离过程的应用,主要是水合氢离子的表示方法的应用,题目较简单.
常温下pH=6的盐酸和pH=6的NH$_4$Cl溶液,其中由水电离出的c(H_)分别为x mol/L、y mol/L,则x与y的关系是( )
分析:
水电离生成氢离子和氢氧根离子,所以酸或碱抑制水电离,含有弱离子的盐水解而促进水电离,据Kw=c(H_)•c(OH_)计算解答.
解答:
解:pH=6的盐酸中由水电离出的c(H_)=10_mol/L=x,pH=6的NH$_4$Cl溶液,其中由水电离出的c(H_)=10_mol/L=y,即x=10_y.
故选A.
点评:
本题考查了弱电解质的电离及盐类水解,根据水电离出的离子确定物质对水电离是抑制还是促进,注意酸溶液中氢离子不等于水电离出的氢离子,为易错点.
常温下,某种溶液中由水电离产生的c(H_)=1×10_mol•L_,该溶液中的溶质不可能是( )
分析:
常温下,某种溶液中由水电离产生的c(H_)=1×10_mol•L_<1.0×10_mol/L,说明水的电离程度减小,该溶质的溶液抑制了水的电离,该溶质可能为酸性溶液,也有可能为碱性溶液;由于弱酸根或弱碱根离子能够促进水的电离,所以不会是强酸弱碱盐或者强碱弱酸盐的溶液.
解答:
解:常温下纯水电离的氢离子浓度为:c(H_)=1.0×10_mol/L,由水电离产生的c(H_)=1×10_mol•L_<1.0×10_mol/L,说明抑制了水电离电离,
A、NaHSO$_4$溶液中,硫酸氢根离子在水溶液中完全电离,电离出氢离子和硫酸根离子,水的电离H$_2$O⇌H_+OH_向逆反应方向移动,抑制了水的电离,所以可能为硫酸氢钠溶液,故A错误;
B、氢氧化钠溶液中,氢氧化钠分离出的氢氧根离子使溶液中氢氧根离子浓度增大,抑制了水的电离,水电离的氢离子浓度减小,所以可能是氢氧化钠溶液,故B错误;
C、氯化氢溶液为强酸性溶液,溶液中氯化氢氢离子使溶液中氢离子浓度增大,抑制了水的电离,溶液中水电离的氢离子浓度减小,所以可能为氯化氢溶液,故C错误;
D、硫酸铝溶液中,铝离子水解结合了水电离的氢氧根离子,促进了水的电离,溶液中水电离的氢离子浓度增大,故D正确.
故选D.
点评:
本题考查了水的电离,题目难度中等,该题是高考中的常见题型,属于中等难度的试题,试题注重基础,侧重考查学生分析问题、解决问题的能力.
在pH为3的FeCl$_3$溶液,pH为11的Na$_2$CO$_3$溶液和pH为3的盐酸中由水电离出来的H_的浓度分别为:C$_1$、C$_2$、C$_3$,它们之间的关系是( )
分析:
FeCl$_3$和Na$_2$CO$_3$都可促进水的电离,盐酸抑制电离,结合溶液的pH判断水的电离程度大小.
解答:
解:FeCl$_3$和Na$_2$CO$_3$都可促进水的电离,pH为3的FeCl$_3$溶液,水电离出来的H_的浓度为10_mol/L,pH为11的Na$_2$CO$_3$溶液,水电离出来的H_的浓度为10_mol/L,
pH为3的盐酸抑制水的电离,水电离出来的H_的浓度为10_mol/L,
则C$_1$=C$_2$>C$_3$,
故选B.
点评:
本题考查盐类水解的应用以及弱电解质的电离等问题,为高考常见题型,综合考查学生的分析能力和综合运用化学知识的能力,注意相关基础知识的理解和积累,难度不大.
25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( )
①KNO$_3$ ②NaOH ③CH$_3$COONH$_4$ ④NH$_4$Cl.
分析:
③CH$_3$COONH$_4$和④NH$_4$Cl水解促进水的电离;①KNO$_3$对水的电离无影响,②NaOH是强碱,抑制水的电离.
解答:
解:③CH$_3$COONH$_4$和④NH$_4$Cl水解促进水的电离,但③CH$_3$COONH$_4$双水解,对水的电离促进更大;①KNO$_3$对水的电离无影响;②NaOH是强碱,抑制水的电离,因此水的电离程度从大到小排列顺序正确的是③CH$_3$COONH$_4$④NH$_4$Cl①KNO$_3$②NaOH,
故选A.
点评:
本题考查水的电离平衡的影响因素,明确盐类的水解可促进水的电离、盐的电离使溶液呈酸性或碱性时抑制水的电离.
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH$_3$COONa溶液.对这两种溶液的判断,正确的是( )
分析:
A、根据H$_2$O⇌H_+OH_,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,CH$_3$COONa促进水的电离;
B、CH$_3$COONa部分水解,则醋酸钠的浓度大于氢氧根离子的浓度;
C、加水稀释促进盐的水解;
D、根据电荷守恒分析.
解答:
解:A、根据H$_2$O⇌H_+OH_,NaOH抑制水的电离,CH$_3$COONa促进水的电离,所以两溶液中水的电离程度不同,故A错误;
B、CH$_3$COONa部分水解,则醋酸钠的浓度大于氢氧根离子的浓度,NaOH完全电离,NaOH的浓度等于氢氧根离子的浓度,所以CH$_3$COONa的浓度大于NaOH的浓度,则c(Na_):①<②,故B错误;
C、加水稀释促进CH$_3$COONa的水解,溶液中氢氧根离子的物质的量增大,所以醋酸钠溶液的PH变化小,则两溶液分别用水稀释10倍后,pH①<pH②<9,故C错误;
D、将①和②等体积混合后的溶液中,存在电荷守恒:c(Na_)+c(H_)=c(CH$_3$COO_)+c(OH_),即溶液存在:c(Na_)=c(CH$_3$COO_)+c(OH_)-c(H_),故D正确;
故选D.
点评:
本题考查了盐的水解、水的电离、溶液中电荷守恒的应用等,题目涉及的内容较多,侧重于有关知识的应用的考查,题目难度中等.