- 第九章 溶液
- 第一节 认识溶液
- 溶液
- 溶解时的吸热放热现象
- 乳化现象
- 第二节 溶液组成的定量表示
- 溶质质量分数
- 有关溶液中溶质的质量分数的计算
- 第三节 溶解度
- 饱和溶液与不饱和溶液
- 溶解度
- 结晶
- 学生实验天地:配置一定溶质的质量分数的溶液
- 第十章 金属
- 第一节 金属与合金
- 几种常见金属的物理性质
- 合金
- 第二节 金属的化学性质
- 金属与氧气的反应
- 金属与酸的反应
- 金属与金属化合物溶液的反应
- 金属活动性顺序
- 第三节 金属的冶炼与防护
- 铁的冶炼
- 金属的腐蚀与防护
- 学生实验天地:金属的物理性质和化学性质
- 第十一章 酸与碱
- 第一节 对酸碱的初步认识
- 酸与碱的识别
- 酸与碱的组成
- 溶液酸碱度-pH
- 第二节 几种常见的酸
- 盐酸
- 硫酸
- 第三节 几种常见的碱
- 碱的物理性质
- 碱的化学性质
- 中和反应
- 学生实验天地:酸、碱化学性质的综合探究
- 第十二章 盐
- 第一节 几种常见的盐
- 氯化钠
- 碳酸钠、碳酸氢钠和碳酸钙
- 第二节 盐的性质
- 盐的性质
- 复分解反应及其发生的条件
- 第三节 化学肥料
- 学生实验天地:粗盐提纯
- 第十三章 化学与社会生活
- 第一节 食物中的营养物质
- 第二节 化学合成材料
- 第三节 化学与环境
《学生实验天地:配置一定溶质的质量分数的溶液》实验全解
一定溶质质量分数的氯化钠溶液的配制
一、实验目的
1.加深对物质溶解、定量表示溶液组成、饱和溶液和溶解度等溶液相关概念及其内在联系的认识和理解。
2.初步学会配制一定溶质的质量分数溶液的基本方法。
二、实验用品
托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、蒸馏水。
三、实验步骤
1.配制室温下含有8 g溶质的质量分数为6%的氯化钠溶液。如图所示。
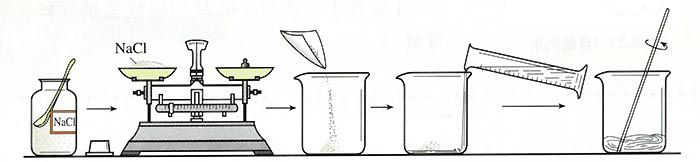
(1)计算:根据溶质质量分数的计算公式,计算配制50g溶质质量分数为6%的氯化钠溶液所需要氯化钠的质量:50g×6%=3g,所需水的质量为50g-3g=47g。
(2)称量:用托盘天平称量3g氯化钠,倒入烧杯中。
(3)量取:把水的密度近似看作$1g/cm^{3}$,用50mL的量简量取47mL水。
(4)溶解:把量好的水倒人盛有氯化钠的烧杯中,用玻璃棒搅搅拌,使氯化纳完全溶解。
(5)装瓶保存:把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,标明药品名称和溶质质量分数,放到试剂柜中。
2.用浓溶液配制稀溶液
用已配好的质量分数为6%的氧化钠溶液(密度约为$1.04g/cm^{3}$)配制50g质量分数为3%的氯化纳溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为6%的氯化钠溶液25g(体积为24mL),水25g(体积为25mL)。
(2)量取:用量筒分别量取质量分数为6%的氯化钠溶液24mL和水25mL,倒人烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液和水混合均匀。
(4)装瓶保存:把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,标明药品名称和溶质质量分数,放到试剂柜中。
四、注意事项
1.托盘天平称量氯化钠时
(1)称量前要先调节天平平衡;
(2)调平衡后,在左、右两盘上各放同样大小的白纸片;
(3)要遵循“左物右码”原则,左边放称量的药品,右边放砝码。
2.用量筒量取液体读数时
读数时视线应与量筒内液体凹液面的最低处保持水平,既不能仰视读数,也不能俯视读数。
溶液配置的误差分析
操作 | 误差分析 | 溶质质量分数 |
用含有不溶性杂质的固体药品来配制溶液 | 溶质的实际质量偏小 | 偏小 |
用托盘天平称量固体药品质量时,砝码放在左盘,药品放在右盘且称量时使用了游码 | 溶质的实际质量偏小 | 偏小 |
用量筒量取浓溶液时俯视读数 | 溶质的实际质量偏小 | 偏小 |
量取水的体积时仰视读数 | 水的实际体积偏大 | 偏小 |
烧杯中原来有少量水 | 水的实际体积偏大 | 偏小 |
将药品倒入烧杯中时有少量撒在外面(或称量纸上残留少量固体药品) | 溶质的实际质量偏小 | 偏小 |
量取水的体积时俯视读数 | 水的实际体积偏小 | 偏大 |
用量筒量取浓溶液时仰视读数 | 溶质的实际质量偏大 | 偏大 |
往烧杯中倒水时有水流出 | 水的实际体积偏小 | 偏大 |
砝码已生锈 | 溶质的实际质量偏大 | 偏大 |
天平使用不正确,如称量前没有调平衡 | 指针右偏(或左偏),溶质的实际质量偏大(或偏小) | 偏大(或偏小) |
将配好的溶液往试剂瓶中转移时有少量溅出 | 不影响 | 不变 |