(多选)将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )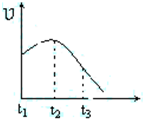
题目答案
您的答案
答案解析
分析:
根据反应的过程图象结合题干关于影响反应速率的因素等信息,对反应过程进行分析判断即可.
解答:
解:A、由于镁与盐酸的反应放热所以可提高反应的速度,t$_1$~t$_2$速度变化变快的主要原因是反应放热使溶液温度升高,故A正确;
B、由于镁与盐酸的反应放热所以可提高反应的速度,t$_1$~t$_2$速度变化变快的主要原因是反应放热使溶液温度升高,故B不正确;
C、t$_2$~t$_3$速度不断变慢,是因为随着氢气的量的增加,镁以及溶液中的氯化氢因反应的消耗不断变少,导致反应速度变慢.此反应在试管中进行,压强基本不变.故C正确;
D、t$_2$~t$_3$速度不断变慢,是因为随着氢气的量的增加,镁以及溶液中的氯化氢因反应的消耗不断变少,导致反应速度变慢.此反应在试管中进行,压强基本不变.故D不正确.
故选AC.
点评:
此题是对影响反应速率的考查,解题的关键是结合图象对反应过程的分析,属实验探究性基础题.
 4NO(g)+6H$_2$O(g),下列叙述正确的是( )
4NO(g)+6H$_2$O(g),下列叙述正确的是( )