- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究什么
- 物理变化和化学变化
- 物理性质和化学性质
- 空气中氧气含量的测定
- 混合物与纯净物
- 第3节 怎样学习和研究化学
- 常用的化学仪器及使用
- 化学实验的基本操作
- 物质性质的探究
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 空气的成分
- 氧气的性质
- 氧气的制法
- 催化剂和催化作用
- 第2节 奇妙的二氧化碳
- 自然界中的二氧化碳
- 二氧化碳的性质和用途
- 化合反应与分解反应
- 二氧化碳的制备与利用
- 第3节 自然界中的水
- 水的组成
- 水的净化
- 水资源的综合利用
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 微粒的性质
- 分子
- 原子
- 离子
- 第2节 组成物质的化学元素
- 元素与元素符号
- 物质的简单分类
- 元素与人体健康
- 第3节 物质的组成
- 化学式与化合价
- 化合物中元素之间的质量关系
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 燃烧与燃烧条件
- 爆炸与爆炸现象
- 防火与灭火
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与应用
- 化学反应的表示方法
- 根据化学方程式的计算
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 金属的性质
- 置换反应
- 合金
- 第2节 金属矿物 铁的冶炼
- 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
《二氧化碳的制备与利用》考点精粹
实验室制取二氧化碳的药品选择
利用大理石(或石灰石,主要成分都是碳酸钙)和稀盐酸反应来制取二氧化碳,因反应速率适中,原料廉价易得,所以在实验室里普遍使用此原料制备二氧化碳。
注意
①不能选用浓盐酸,因为浓盐酸易挥发出$HCl$气体,导致得到的$CO _ {2}$不纯。②不能选用稀硫酸,因为稀硫酸与大理石(或石灰石)反应生成微溶于水的硫酸钙,碗酸钙会附着在大理石(或石灰石)的表面,阻止反应继续进行,不能连续、大量地制得$CO _ {2}$气体。③不能选用碳酸钠等纯净物的粉末代替石灰石,因为反应太剧烈,反应速率太快,产生的气体不便于收集。
拓展
工业上制取二氧化碳的方法、原理:高温煅烧石灰石生成石灰石$( CaO )$和二氧化碳:$CaCO _ {3} \stackrel {\text {高温}} {=}CaO+ CO _ {2} \uparrow$。
实验室制取二氧化碳的反应原理
实验室制取二氧化碳的反应原理为$CaCO _ {3} + 2 HCl = CaCl _ {2} + H _ {2} O +CO _ {2} \uparrow $。
确定实验室制取气体的反应原理要考虑该反应是否易操作、原料是否易得、生成的气体是否易收集、反应条件是否易达到等因素。
实验室制取二氧化碳的装置
(1)发生装置
①选择依据:反应物的状态和反应条件。
②选择装置:实验室制取CO2所用反应物是固体与液体,反应条件是常温,属于固+液→气型,发生装置与用双氧水和二氧化锰制取O2的装置相似,如图所示,A为简易装置,可制取少量气体,B装置使用了长颈漏斗,便于添加液体;C装置添加了多孔塑料片或橡胶片,可使反应即开即停;D装置使用分液漏斗,除了便于添加液体外,还能利用活塞控制滴液的快慢,便于控制反应速率。
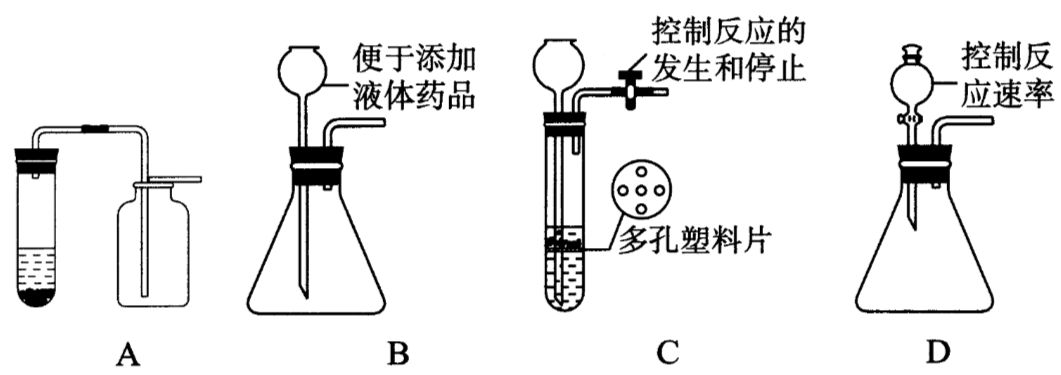
(2)收集装置
①选择依据:气体的密度和溶解性。
②选择装置:CO2能溶于水且能与水反应,不宜用排水法;密度大于空气,只能用向上排空气法。
说明
①B中长颈漏斗下端管口必须插到液面以下,否则生成的气体会从长颈漏斗口逸出;A中导管伸入发生装置内不能太长,更不能插到液面以下。
②导管伸入集气瓶时,末端必须插到集气瓶底,便于排净集气瓶内的空气,使收集到的CO2气体更纯净。
实验室制取二氧化碳气体
1. 实验室制取气体的一般思路

2. 实验室制取二氧化碳气体
(1)药品:大理石(或石灰石,主要成分是碳酸钙)与稀盐酸。
(2)原理:$CaCO _ {3} + 2 HCl = CaCl _ {2} + H _ {2} CO _ {3}$
碳酸钙氯化钙碳酸
碳酸不稳定,在常温下就可以分解生成二氧化碳和水。
$H _ {2} CO _ {3} = H _ {2} O + CO _ {2} \uparrow$
总的化学方程式是:
$CaCO _ {3} + 2 HCl = CaCl _ {2} + CO _ {2} \uparrow + H _ {2} O$
3. 发生装置与收集裝置的选择
实验室制取二氧化碳气体 | |
药品 | 稀盐酸与大理石(或石灰石) |
反应物的状态 | 稀盐酸为液体,大理石(或石灰石)为固体 |
反应条件 | 常温 |
发生装置 |  |
气体性质 | 相同条件下密度比空气大 |
能溶于水且与水发生反应 | |
收集装置 |  |
4. 制取步骤
